오늘은 미국 국립 생명공학 정보 센터 (National Center for Biotechnology Information)에 게제된 "당뇨병 및 합병증에 대한 니겔라 사티바(블랙씨드)의 잠재적 건강상의 이점 : 실험실 연구에서 임상 시험에 이르는 검토"에 대한 자료를 공유해 드리고자 합니다.
원본의 출처는 아래와 같습니다.
판매자도 지난 5년간 계속 복용하고 있는 뷰티텐더 블랙씨드(캡슐타입)입니다.

This review aims to gather and summarize up-to-date information on the potential health benefits of Nigella sativa (NS) on diabetes mellitus (DM) and its complications from different animal models, clinical trials and in vitro studies. DM is one of the ...
www.ncbi.nlm.nih.gov
Potential health benefits of Nigella sativa on diabetes mellitus and its complications: A review from laboratory studies to clinical trials
당뇨병 및 합병증에 대한 니겔라 사티바(블랙씨드)의 잠재적 건강상의 이점 : 실험실 연구에서 임상 시험에 이르는 검토
Siti Hajar Adam, 1 Noor Mohd Nasri, 2 , 3 Mohd Izhar Ariff Mohd Kashim, 4 , 5 Erny Haslina Abd Latib, 6 Muhammad Amirul Aiman Ahmad Juhari, 7 and Mohd Helmy Mokhtar 3 , *Author information Article notes Copyright and License information PMC Disclaimer
Abstract (개요)
This review aims to gather and summarize up-to-date information on the potential health benefits of Nigella sativa (NS) on diabetes mellitus (DM) and its complications from different animal models, clinical trials and in vitro studies. DM is one of the most prevalent metabolic disorders resulting from chronic hyperglycaemia due to problems in insulin secretion, insulin action or both. It affects people regardless of age, gender and race. The main consequence of DM development is the metabolic dysregulation of glucose homeostasis. Current treatments for DM include pharmacological therapy, insulin and diabetic therapy targeting β cells. Some of these therapeutic approaches are promising; however, their safety and effectiveness remain elusive. Since ancient times, medicinal plants have been used and proven effective against diseases. These plants are believed to be effective and benefit physiological and pathological processes, as they can be used to prevent, reduce or treat multiple diseases. Nigella sativa Linn. is an annual indigenous herbaceous plant belonging to Ranunculaceae, the buttercup family. NS exhibits multifactorial activities; it could ameliorate oxidative, inflammatory, apoptotic and insulinotropic effects and inhibit carbohydrate digestive enzymes. Thus, this review demonstrates the therapeutic potential of NS that could be used as a complement or adjuvant for the management of DM and its complications. However, future research should be able to replicate and fill in the gaps of the study conducted to introduce NS safely to patients with DM.
이 리뷰는 다양한 동물 모델, 임상 시험 및 시험관 연구를 통해 당뇨병(DM) 및 그 합병증에 대한 니겔라 사티바(NS)의 잠재적 건강 효능에 대한 최신 정보를 수집하고 요약하는 것을 목표로 합니다. 당뇨병은 인슐린 분비, 인슐린 작용 또는 둘 다의 문제로 인한 만성 고혈당증으로 인해 발생하는 가장 흔한 대사 장애 중 하나입니다. 나이, 성별, 인종에 관계없이 모든 사람에게 영향을 미칩니다. 당뇨병 발병의 주요 결과는 포도당 항상성의 대사 조절 장애입니다. 현재 당뇨병의 치료법에는 β 세포를 표적으로 하는 약물 요법, 인슐린 및 당뇨병 치료법이 있습니다. 이러한 치료법 중 일부는 유망하지만, 그 안전성과 효과는 아직 밝혀지지 않았습니다. 고대부터 약용 식물이 사용되어 왔으며 질병에 대한 효과가 입증되었습니다. 이러한 식물은 여러 질병을 예방, 감소 또는 치료하는 데 사용할 수 있기 때문에 생리적 및 병리학적 과정에 효과적이고 유익하다고 믿어집니다. 미나리아재비과에 속하는 일년생 토착 초본 식물인 니겔라 사티바 린(Nigella sativa Linn.)입니다. NS는 산화, 염증, 세포 사멸 및 인슐린 저항성 효과를 개선하고 탄수화물 소화 효소를 억제하는 등 다인성 활성을 나타냅니다. 따라서 이 리뷰는 당뇨병과 그 합병증 관리를 위한 보완제 또는 보조제로 사용될 수 있는 NS의 치료 잠재력을 보여줍니다. 그러나 향후 연구에서는 당뇨병 환자에게 NS를 안전하게 도입하기 위해 수행된 연구의 부족한 부분을 보완하고 복제할 수 있어야 합니다.
Keywords: Nigella sativa, thymoquinone, diabetes mellitus, antidiabetic, antioxidative, hypoglycaemic
키워드: 니겔라 사티바, 티모퀴논, 당뇨병, 항당뇨, 항산화, 저혈당증
Introduction (도입)
Diabetes mellitus (DM) is one of the most prevalent metabolic disorders resulting from chronic hyperglycaemia due to problems in insulin secretion, insulin action, or both (1, 2). It affects people regardless of age, gender and race. The main consequence of DM development and the considerable morbidity and mortality it causes is the metabolic dysregulation of glucose homeostasis (3). The following classical classifications of DM were proposed by the American Diabetes Association in 1997: type 1 diabetes mellitus (T1DM), type 2 diabetes mellitus (T2DM), gestational DM, and specific types of diabetes due to other causes (4). T1DM and T2DM are the most common types of DM (2). Approximately 90–95% of those with DM develop T2DM (4). Global prevalence data from the International Diabetes Federation Atlas 2013 showed that the prevalence of DM in adults aged 20–79 years is 8.3% (382 million) of the worldwide population (2).
당뇨병(DM)은 인슐린 분비, 인슐린 작용 또는 둘 다의 문제로 인한 만성 고혈당증으로 인해 발생하는 가장 흔한 대사 장애 중 하나입니다(1, 2). 나이, 성별, 인종에 관계없이 모든 사람에게 영향을 미칩니다. 당뇨병 발병과 이로 인한 상당한 이환율 및 사망률의 주요 결과는 포도당 항상성의 대사 조절 장애입니다(3). 1997년 미국 당뇨병 협회에서 제안한 당뇨병의 고전적인 분류는 다음과 같습니다: 제1형 당뇨병(T1DM), 제2형 당뇨병(T2DM), 임신성 당뇨병 및 기타 원인으로 인한 특정 유형의 당뇨병(4). T1DM과 T2DM은 가장 흔한 유형의 당뇨병입니다(2). 당뇨병 환자의 약 90~95%가 제2형 당뇨병으로 발전합니다(4). 국제 당뇨병 연맹 아틀라스 2013의 전 세계 유병률 데이터에 따르면 20-79세 성인의 당뇨병 유병률은 전 세계 인구의 8.3%(3억 8,200만 명)에 달합니다(2).
T2DM is characterized predominantly by insulin resistance with relative insulin deficiency, which increases the insulin demand of insulin-target tissues (4–6). Insulin levels may appear normal or elevated with normal β cell function, but their secretion is defective and insufficient to compensate for insulin resistance (5). People with T2DM are usually obese, and obesity is able to cause some degree of insulin resistance (5, 6). Additionally, those with an increased percentage of body fat distributed in the abdominal region are also affected by T2DM (5, 6). Nevertheless, diabetes-related health conditions can be prevented with pharmacological treatment and insulin. For example, metformin remains essential in treating T2DM, particularly for obese and overweight people (7). Metformin is necessary, as it increases insulin sensitivity and suppresses hepatic gluconeogenesis (8). Other therapeutic approaches include gene therapy, diabetic therapy targeting β cells and β cell regeneration, stem cells and enhancing the self-replication of β cells. Some of these therapeutic approaches are promising; however, their safety and effectiveness remain elusive (7).
제2형 당뇨병은 주로 상대적 인슐린 결핍을 동반한 인슐린 저항성이 특징이며, 이는 인슐린 표적 조직의 인슐린 수요를 증가시킵니다(4-6). 인슐린 수치는 정상으로 보이거나 정상적인 베타 세포 기능으로 상승할 수 있지만, 인슐린 분비에 결함이 있어 인슐린 저항성을 보상하기에 충분하지 않습니다(5). 제2형 당뇨병 환자는 일반적으로 비만이며, 비만은 어느 정도의 인슐린 저항성을 유발할 수 있습니다(5, 6). 또한 복부에 분포된 체지방 비율이 높은 사람들도 제2형 당뇨병의 영향을 받습니다(5, 6). 그럼에도 불구하고 당뇨병 관련 건강 상태는 약물 치료와 인슐린으로 예방할 수 있습니다. 예를 들어, 메트포르민은 특히 비만 및 과체중 환자의 제2형 당뇨병 치료에 필수적입니다(7). 메트포르민은 인슐린 감수성을 증가시키고 간 포도당 생성을 억제하기 때문에 필요합니다(8). 다른 치료 접근법으로는 유전자 치료, β 세포를 표적으로 하는 당뇨병 치료 및 β 세포 재생, 줄기세포, β 세포의 자기 복제 강화 등이 있습니다. 이러한 치료 접근법 중 일부는 유망하지만 안전성과 효과는 아직 밝혀지지 않았습니다(7).
블랙씨드 오일 구매는 '뷰티텐더 블랙씨드(캡슐타입)'로~
Since ancient times, medicinal plants have been used and proven effective against diseases. These plants are believed to be effective and benefit physiological and pathological processes, as they can prevent, reduce or treat multiple diseases (9). Nigella sativa Linn. (NS; Figure 1) is an annual indigenous herbaceous plant that belongs to the buttercup family Ranunculaceae, a family of flowering plants, and the genus Nigella with 14 species, including N. arvensis, N. ciliaris, N. damascene, N. hispanica, N. integrifolia, N. nigellastrum, N. orientalis, and NS (10). Previously, NS is used only as a spice and in traditional medicine. However, nowadays, it is used extensively in the pharmaceutical and food industries (11).
고대부터 약용 식물은 질병에 효과가 있는 것으로 입증되어 사용되어 왔습니다. 이러한 식물은 여러 질병을 예방, 감소 또는 치료할 수 있기 때문에 생리적 및 병리학적 과정에 효과적이고 유익하다고 믿어집니다 (9). (NS; 그림 1)는 한해살이 토착 초본 식물로, 미나리과 미나리아재비과에 속하며 꽃 식물과에 속하는 니겔라 속에는 N. 아르벤시스, N. 실라리스, N. 다마센, N. 히스패니카, N. 인테그리폴리아, N. 니겔라스트럼, N. 오리엔탈리스 및 NS를 포함한 14종이 포함되어 있습니다(10). 이전에는 NS가 향신료와 전통 의학에서만 사용되었습니다. 그러나 오늘날에는 제약 및 식품 산업에서 광범위하게 사용됩니다 (11).

Figure 1
Nigella sativa plants and seeds.
그림 1
니겔라 사티바 식물과 씨앗.
NS constitutes a broad spectrum of therapeutic activities, including antidiabetic, diuretic, antihypertensive, anticancer, immunomodulatory, analgesic, antimicrobial, anthelmintic, anti-inflammatory, spasmolytic, bronchodilatory, gastroprotective, hepatoprotective, renal protective, antifungal, and antioxidant properties; increases maternal lactation and fertility and boosts the immune system (12, 13). NS's antidiabetic effects could improve clinical and glycaemic control in DM (14). In addition, numerous clinical studies have demonstrated the efficacy of NS on DM (15).
NS는 항당뇨, 이뇨, 항고혈압, 항암, 면역조절, 진통, 항균, 구충, 항염, 경련 완화, 기관지 확장, 위장 보호, 간 보호, 신장 보호, 항진균, 항산화 등 광범위한 치료 작용을 하며 산모의 수유력과 생식력을 높이고 면역 체계를 강화합니다(12, 13). NS의 항당뇨 효과는 당뇨병 환자의 임상 및 혈당 조절을 개선할 수 있습니다(14). 또한 수많은 임상 연구를 통해 당뇨병에 대한 NS의 효능이 입증되었습니다(15).
Several reviews have been conducted pertaining to the broad pharmacological effects of NS. However, very little literature has been done specifically on DM and its complications.
NS의 광범위한 약리학적 효과에 관한 여러 연구가 수행되었습니다. 그러나 당뇨병과 그 합병증에 대해 구체적으로 연구된 문헌은 거의 없습니다.
Thus, this review aims to gather and summarize up-to-date information on the potential health benefits of NS on DM and its complications from different animal models, clinical trials and in vitro studies. We also highlight the utilization of NS as the precursor to synthesize nanoparticles, which are beneficial in managing DM. Besides that, this review also specifies the different DM animal models and study designs, as well as the type of NS used in the study to perceive how NS influences the outcome in DM management. The findings could help provide a basis for developing new complementary antidiabetic medications with fewer side effects and excellent efficacy.
따라서 이 리뷰는 다양한 동물 모델, 임상 시험 및 시험관 연구에서 나온 NS가 당뇨병과 그 합병증에 미치는 잠재적인 건강상의 이점에 대한 최신 정보를 수집하고 요약하는 것을 목표로 합니다. 또한 당뇨병 관리에 도움이 되는 나노 입자 합성을 위한 전구체로서 NS의 활용에 대해서도 강조합니다. 그 외에도 이 리뷰에서는 다양한 DM 동물 모델과 연구 설계, 연구에 사용된 NS의 유형을 명시하여 NS가 DM 관리 결과에 어떤 영향을 미치는지 파악합니다. 이러한 연구 결과는 부작용이 적고 효능이 우수한 새로운 보완적 항당뇨병 약물을 개발하는 데 기초를 제공할 수 있습니다.
Methods (방법)
A literature search was performed to identify and map out relevant articles related to the effects of NS on DM. Peer-reviewed, full-text English articles up to May 2022 were collected from electronic databases, including Scopus, MEDLINE via EBSCOhost and Google Scholar. The following set of keywords was used: (1) “Nigella sativa” or “Nigella sativa oil” or “Nigella sativa extracts” and (2) “diabetes mellitus.” The literature search was further supplemented by referencing related review articles and scientific reports found in the search results. All available in vitro, in vivo and human studies that reported the effects of NS or NS oil or NS seed on DM were included in this review. Meanwhile, studies on the effects of an individual bioactive component of NS, the mixture of NS with other herbs and studies on gestational diabetes (GDM) were excluded.
문헌 검색을 통해 NS가 DM에 미치는 영향과 관련된 관련 논문을 식별하고 매핑했습니다. 2022년 5월까지의 동료 검토를 거친 영어 논문 전문은 Scopus, EBSCOhost를 통한 MEDLINE, Google Scholar를 포함한 전자 데이터베이스에서 수집했습니다. 다음과 같은 키워드 세트가 사용되었습니다: (1) "니겔라 사티바" 또는 "니겔라 사티바 오일" 또는 "니겔라 사티바 추출물", (2) "당뇨병". 검색 결과에서 발견된 관련 리뷰 논문과 과학 보고서를 참조하여 문헌 검색을 더욱 보완했습니다. 이 검토에는 NS 또는 NS 오일 또는 NS 씨앗이 당뇨병에 미치는 영향을 보고한 모든 시험관, 생체 내 및 인체 연구가 포함되었습니다. 한편, NS의 개별 생리 활성 성분의 효과에 대한 연구, NS와 다른 허브의 혼합물 및 임신성 당뇨병 (GDM)에 대한 연구는 제외되었습니다.
Physicochemical and phytochemical contents of NS (NS의 물리화학적 및 파이토케미컬 함량)
NS is composed of remarkable levels of iron, copper, zinc, phosphorus, calcium, thiamin, niacin, pyridoxine, and folic acid (12, 16, 17). Additionally, it has a maximal nutritional value, including substantial amounts of vegetable protein (20–85%), fiber (7–94%), fat (38.02%), and carbohydrate (31.94%) (18). NS also has various amino acid components, including glutamate, arginine and aspartate, as well as cysteine and methionine (18). In addition, NS seeds contain 26–34% fixed oil from major fatty acids, such as linoleic acid (64.6%) and palmitic acid (20.4%) (17). Furthermore, NS seed oil comprises 0.4–2.5% essential oil (19).
NS는 철, 구리, 아연, 인, 칼슘, 티아민, 니아신, 피리독신, 엽산(12, 16, 17)의 놀라운 수준으로 구성되어 있습니다. 또한 상당한 양의 식물성 단백질(20-85%), 섬유질(7-94%), 지방(38.02%), 탄수화물(31.94%)을 포함한 최대 영양가를 가지고 있습니다(18). NS에는 글루타메이트, 아르기닌, 아스파르트산염, 시스테인, 메티오닌 등 다양한 아미노산 성분도 함유되어 있습니다(18). 또한 NS 씨앗에는 리놀레산(64.6%)과 팔미트산(20.4%)과 같은 주요 지방산의 고정유가 26~34% 함유되어 있습니다(17). 또한 NS 종자유는 0.4-2.5%의 에센셜 오일로 구성되어 있습니다(19).
1알에 1000mg, 냉압착으로 착유한 터키산 블랙오일~
Various factors can affect NS's phytochemical content, including the growing areas, maturation stage, processing procedures and isolation techniques (20). Using different extraction methods or solvents, some researchers also found different compounds that other studies have not report. For instance, in oil samples extracted with a cold press, hexane, tetrahydrofuran, ethanol, dichloromethane, and methanol produced various amounts of thymoquinone (21). Many studies have been conducted to determine the bioactive components of NS. Table 1 summarizes the various phytochemical compounds of NS that have been identified from different origins.
재배 지역, 성숙 단계, 가공 절차 및 분리 기술 등 다양한 요인이 NS의 파이토케미컬 함량에 영향을 미칠 수 있습니다(20). 일부 연구자들은 다른 추출 방법이나 용매를 사용하여 다른 연구에서 보고하지 않은 다른 화합물을 발견하기도 했습니다. 예를 들어, 콜드 프레스로 추출한 오일 샘플에서 헥산, 테트라하이드로푸란, 에탄올, 디클로로메탄, 메탄올은 다양한 양의 티모퀴논을 생성했습니다(21). NS의 생리 활성 성분을 확인하기 위해 많은 연구가 수행되었습니다. 표 1에는 다양한 출처에서 확인된 NS의 다양한 파이토케미컬 화합물이 요약되어 있습니다.
Table 1
Phytochemical compounds of NS from different origins.
|
Origin
|
Type
|
Major phytochemical compounds
|
Potential activity
|
References
|
|
Iran
|
Seed
|
α-thujene (PubChem-17868)
α-pinene (PubChem-6654) sabinene (PubChem-18818) 3-carene (PubChem-26049) P-cymene (PubChem-7463) γ-terpinene (PubChem-7461) trans-sabinene hydrate (PubChem-6427504) thymoquinone (PubChem-10281) thymol (PubChem-6989) longifolene (PubChem-289151) palmatic acid (PubChem-985) |
Antioxidant
Antitumour |
(22)
|
|
Turkey
|
Seed
|
α-thujene (PubChem-17868)
o-cymene (PubChem-10703) limonene (PubChem-22311) γ-terpinene (PubChem-7461) terpinen-4-ol (PubChem-2724161) methyl chavicol (PubChem-66957732) tymoquinone (PubChem-10281) trans-sabynil acetate (PubChem-6430313) carvacrol (PubChem-10364) longifolene (PubChem-289151) (E)-caryophyllene (PubChem-5354499) |
Antimicrobial
Antituberculosis Antifungal |
(23)
|
|
Tunisia
|
Seed, shoot, and root
|
p-cymene (PubChem-7463)
α-thujene (PubChem-17868) α-pinene (PubChem-6654) β-pinene (PubChem-14896) limonene (PubChem-22311) γ-terpinene (PubChem-7461) gallic acid (PubChem-370) (–)-p-hydroxybenzoic acid (PubChem-135) chlorogenic acid (PubChem-1794427) vanillic acid (PubChem-8468) p-coumaric (PubChem-637542) ferulic acid (PubChem-445858) trans-2-hydroxycinnamic acid (PubChem-54693535) trans-cinnamic acid (PubChem-16213746) epicatechin (PubChem-72276) (+)-catechin (PubChem-73160) quercetin (PubChem-5280343) apigenin (PubChem-5280443) amentoflavone (PubChem-5281600) flavone (PubChem-10680) |
Anticariogenic
Antimutagenic |
(24, 25)
|
|
Bangladesh
|
Seed
|
p-cymene (PubChem-7463)
thymoquinone (PubChem-10281) α-thujene (PubChem-17868) carvacrol (PubChem-10364) β-pinene (PubChem-14896) limonene (PubChem-22311) methyl linoleate (PubChem-5284421) sabinene (PubChem-18818) |
Not mentioned
|
(26)
|
|
India
|
Seed
|
p-cymene (PubChem-7463)
α-thujene (PubChem-17868) thymoquinone (PubChem-10281) propyl-4- methyl-1-cyclohexene (PubChem-11572) sabinene (PubChem-18818) terpinen-4-ol (PubChem-2724161) trans-4-methoxy-thujane (PubChem-129845680) γ-terpinene (PubChem-7461) |
Antibacterial
Anticancer Antidiabetic Proapoptotic Antiproliferative |
(26–29)
|
|
Poland
|
Seed
|
p-cymene (PubChem-7463)
γ-terpinene (PubChem-7461) α-thujene (PubChem-17868) carvacrol (PubChem-10364) α-pinene (PubChem-6654) β-pinene (PubChem-14896) |
Not mentioned
|
(30)
|
표 1
다양한 기원의 NS의 식물화학적 화합물.
|
기원
|
유형
|
주요 식물화학적 화합물
|
잠재적인 활동
|
참고자료
|
|
이란
|
씨앗
|
α-thujene(PubChem-17868)
α-pinene(PubChem-6654) sabinene(PubChem-18818) 3-carene(PubChem-26049) P-cymene(PubChem-7463) γ-terpinene(PubChem-7461) trans-sabinene hydrate (PubChem-6427504) 티모퀴논(PubChem-10281) 티몰(PubChem-6989) 롱기폴렌(PubChem-289151) 팔마틱산(PubChem-985) |
항산화
항종양 |
( 22 )
|
|
터키
|
씨앗
|
α-thujene(PubChem-17868)
o-cymene(PubChem-10703) 리모넨(PubChem-22311) γ-terpinene(PubChem-7461) terpinen-4-ol(PubChem-2724161) 메틸 차비콜(PubChem-66957732) 티모퀴논(PubChem -10281) 트랜스사비닐 아세테이트(PubChem-6430313) 카르바크롤(PubChem-10364) 롱기폴렌(PubChem-289151) (E)-카리오필렌(PubChem-5354499) |
항균제
항결핵제 항진균제 |
( 23 )
|
|
튀니지
|
씨앗, 싹, 뿌리
|
p-시멘(PubChem-7463)
α-thujene(PubChem-17868) α-피넨(PubChem-6654) β-피넨(PubChem-14896) 리모넨(PubChem-22311) γ-테르피넨(PubChem-7461) 갈산(PubChem -370) (–)-p-하이드록시벤조산(PubChem-135) 클로로겐산(PubChem-1794427) 바닐산(PubChem-8468) p-쿠마르산(PubChem-637542) 페룰산(PubChem-445858) 트랜스-2-하이드록시신남산 산성(PubChem-54693535) 트랜스계피산(PubChem-16213746) 에피카테킨(PubChem-72276) (+)-카테킨(PubChem-73160) 케르세틴(PubChem-5280343 ) 아피게닌(PubChem-5280443) 아멘토플라본(PubChem-52816 00) 플라본 (PubChem-10680) |
항우식성
항돌연변이성 |
( 24 , 25 )
|
|
방글라데시
|
씨앗
|
p-시멘(PubChem-7463)
티모퀴논(PubChem-10281) α-thujene(PubChem-17868) 카르바크롤(PubChem-10364) β-피넨(PubChem-14896) 리모넨(PubChem-22311) 메틸 리놀리에이트(PubChem-5284421) 사비넨 (PubChem-18818) |
언급되지 않은
|
( 26 )
|
|
인도
|
씨앗
|
p-사이멘(PubChem-7463)
α-투젠(PubChem-17868) 티모퀴논(PubChem-10281) 프로필-4-메틸-1-사이클로헥센(PubChem-11572) 사비넨(PubChem-18818) 테르피넨 -4-올(PubChem- 2724161) trans-4-methoxy-thujane (PubChem-129845680) γ-terpinene (PubChem-7461) |
항균제
항암제 항 당뇨병제 Proapoptotic 항증식제 |
( 26 – 29 )
|
|
폴란드
|
씨앗
|
p-시멘(PubChem-7463)
γ-테르피넨(PubChem-7461) α-thujene(PubChem-17868) 카르바크롤(PubChem-10364) α-피넨(PubChem-6654) β-피넨(PubChem-14896) |
언급되지 않은
|
( 30 )
|
Thymoquinone, thymohydroquinone, dithymoquinone, p-cymene, carvacrol, terpinen-4-ol, t-anethol, sesquiterpene longifolene, α-pinene, and thymol are the major phytochemical compounds found in NS (Figure 2) (12). Thymoquinone is the major active principle of NS oil and exhibits antidiabetic and antitumour activity against breast, lung, prostate, liver, colon and pancreatic cancers (31). Findings from previous studies revealed that thymoquinone accounts for 38–40% of total NS bioactive components (32). On the other hand, Singh et al. (33) reported p-cymene as the major component with 36.2% in the NS essential oil and linoleic acid as the major component with 53.60% using acetone extract. Besides these compounds, other compounds are found in trace amounts, such as camphene, sabinene, phenol, 2-methyl-5-(1-methyl ethyl), α-terpinene, β-terpinene, γ-terpinene, limonene, and many others.
티모퀴논, 티모하이드로퀴논, 디티모퀴논, p-시멘, 카르바크롤, 테르피넨-4-올, 티-아네톨, 세스키테르펜 롱이폴렌, α-피넨, 티몰은 NS에서 발견되는 주요 파이토케미컬 화합물입니다(그림 2)(12). 티모퀴논은 NS 오일의 주요 활성 원리이며 유방암, 폐암, 전립선암, 간암, 대장암, 췌장암에 대한 항당뇨 및 항종양 활성을 나타냅니다(31). 이전 연구 결과에 따르면 티모퀴논은 전체 NS 생리 활성 성분의 38-40%를 차지하는 것으로 나타났습니다(32). 반면 Singh 등(33)은 NS 에센셜 오일에서 36.2%의 주요 성분으로 p-시멘을, 아세톤 추출물을 사용하여 53.60 %의 주요 성분으로 리놀레산을 보고했습니다. 이 화합물 외에도 캄펜, 사비넨, 페놀, 2-메틸-5-(1-메틸 에틸), α-테르피넨, β-테르피넨, γ-테르피넨, 리모넨 등의 화합물이 미량으로 발견됩니다.
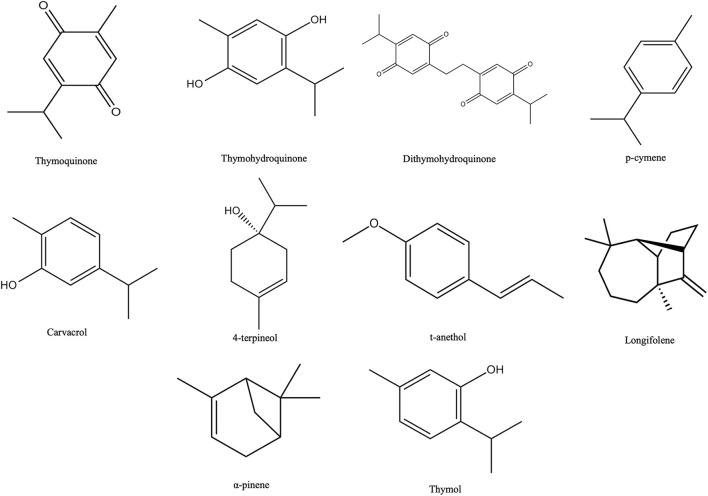
Figure 2
Chemical structures of major phytochemical compounds in NS.
그림 2
NS의 주요 파이토케미컬 화합물의 화학 구조.
Effect of NS on DM (NS의 당뇨병에 대한 영향)
One of the most explored properties of NS is its antidiabetic potential. Studies involving different animal models, clinical trials, and in vitro studies have been conducted widely. This study reviewed 50 studies, including 31 animal studies, six in vitro studies, and 13 clinical trials. Both NS oil and extracts possess antidiabetic properties, as summarized in Table 2, and their proposed mechanism is illustrated in Figure 3.
NS의 가장 많이 연구된 특성 중 하나는 항당뇨 잠재력입니다. 다양한 동물 모델, 임상 시험 및 시험관 내 연구와 관련된 연구가 광범위하게 수행되었습니다. 이 연구에서는 동물 연구 31건, 시험관 연구 6건, 임상 시험 13건을 포함한 50건의 연구를 검토했습니다. 표 2에 요약된 바와 같이 NS 오일과 추출물 모두 항당뇨 효능을 가지고 있으며, 그 메커니즘은 그림 3에 설명되어 있습니다.
1병에 100캡슐... 국내에 정식으로 수입된 터키산 블랙씨드 오일~
Table 2
Summary of NS's effects on DM and its complications from in vivo and in vitro studies.
|
Diabetic animal model/in vitro
|
Treatment dosage
|
Duration of study
|
Outcomes of the study/major findings
|
References
|
|
Female Wistar rats induced with 50 mg/kg STZ
|
0.2 mg/kg/day NS oil
|
30 days
|
↓ Blood glucose levels, serum total oxidant status (TOS) and MDA
↑ SOD and total antioxidant status (TAS) |
(34)
|
|
Female Wistar rats induced with 45 mg/kg STZ
|
400 mg/kg NS oil
|
21 days
|
↓ Blood glucose levels; cardioprotective effect evidenced
↓ Myositis, hyaline degeneration, and Zenker's necrosis ↑ Bcl-2 expression |
(35)
|
|
Adult female Wistar rats induced with 55 mg/kg STZ
|
2 mL/kg NS oil
|
10 weeks
|
↓ Albuminuria and the kidney weight/body weight ratio
↑ Podocin (podocyte-specific marker) ↓ Collagen IV, TGF-β1, and VEGF-A |
(36)
|
|
Adult male Wistar rats induced with 60 mg/kg STZ
|
1 mL/kg NS oil
|
2 weeks
|
↓ Heart and brain nitric oxide (NO) and MDA
↑ GST, GSH, CAT, and serum CK-MB Restored norepinephrine, dopamine, and serotonin |
(37)
|
|
Male Syrian hamsters induced with 230 mg/kg nicotinamide and 65 mg/kg STZ
|
400 mg/kg NS oil
|
4 weeks
|
↓ Blood glucose
↑ Insulin levels, ↑ pancreatic insulin immunoreactivity % |
(38)
|
|
Hamster induced by 65 mg/kg STZ
|
400 mg/kg NS oil
|
4 weeks
|
↓ Blood glucose levels and HbA1c
↓ Glucose production in isolated hepatocytes in response to incubation with gluconeogenic precursors (alanine, glycerol, and lactate) ↑ Phagocytic activity and phagocytic index of peritoneal macrophages and lymphocyte count in peripheral blood |
(39)
|
|
Wistar rats induced by 75 mg/kg STZ
|
400 mg/kg/day NS oil and TQ
|
6 weeks
|
↓ Blood glucose levels but not parallel by stimulation to an insulin release
|
(40)
|
|
Male Wistar albino rats treated with HFD for 2 weeks and 35 mg/kg STZ
|
2 mL/kg NS oil
|
21 days
|
↓ Brain TBARS, NO, and XO; ↑ GSH, GPx, GST, and SOD
↓ Sera and brain TNF-α, IL-6, IL-1β, iNOS NFκ-Bp65, and AGEs ↓ AChE (cholinergic function marker) ↓ Aβ-42 clearance by IDE ↑ GSK-3β level ↓ APP, BACE1, RAGEs, p53, and NF-κBp65 ↑ BDNF, SIRT1, ADAM10 gene expression ↑ IR, PI3K, IRS1-pTyr612, AKT1-pSer473, and GSK-3β-pSer9 |
(41)
|
|
Male albino Sprague–Dawley rats treated with HFD for 2 weeks and 35 mg/kg STZ
|
100 mg/kg NS oil
|
21 days
|
↑ Insulin receptor expression, Insulin like growth factor-1 (IGF-1) and phosphoinositide-3 kinase (PI3K)
↓ ADAM-17, blood glucose levels, lipid profile, TBARS, NO, serum insulin/insulin receptor ratio, and TNF-α |
(42)
|
|
Adult male Wistar rat induced by 45 mg/kg STZ
|
2 mL/kg NS oil
|
30 days
|
↓ FBG
↑ Insulin levels, ↑ Pancreatic and hepatic CAT and GSH, ↑ Insulin immunoreactivity % and mean pancreatic islet diameter ↑ Lipid profile |
(43)
|
|
New Zealand male rabbit induced with 150 mg/kg 10% alloxan
|
20 mL/kg NS seeds aqueous extract
|
2 months
|
↓ Glucose and MDA concentrations
↑ GSH and ceruloplasmin concentrations ↓ LPO-induced liver damage |
(44)
|
|
Female Wistar albino rats induced with 50 mg/kg STZ
|
0.2 mL/kg NS volatile oil
|
4 weeks
|
↑ Insulin immunoreactive parts % and preservation of β-cell number moderate
↑ Increase in the lowered secretory vesicles with granules ↓ Destruction with loss of cristae within the mitochondria of β-cell |
(45)
|
|
Male Wistar rats induced with 60 mg/kg STZ
|
100, 200 and 400 mg/kg NS seed ethanolic extracts
|
6 weeks
|
↓ Serum glucose and lipids
↑ eNOS ↓ VCAM-1 and LOX-1 ↓AGE and aldose reductase level |
(46)
|
|
Male Wistar rats induced with 60 mg/kg STZ
|
200 and 400 mg/kg NS hydroalcoholic extracts
|
42 days
|
↓ Serum glucose levels
↓ MDA ↑ Thiol content of the hippocampus |
(47)
|
|
Female Wistar rats induced with 200 mg/kg alloxan
|
0.2 g/kg NS aqueous extract
|
6–8 weeks
|
↓ Blood glucose levels
↑ Insulin level and HDL-C ↓ TGs, TC, LDL-C, and TBARS |
(48)
|
|
Male Sprague–Dawley rats induced with 60 mg/kg STZ
|
4.0% fixed oil and 0.3% essential oil
|
8 weeks
|
↑ Hepatic SOD, CAT
↓ NO production ↑ Tocopherol content and expression of hepatic enzymes (glutathione peroxidase glutathione reductase and glutathione transferase) |
(49)
|
|
Male Wistar rats induced with 60 mg/kg STZ
|
200 and 400 mg/kg NS hydroalcoholic extracts
|
6 weeks
|
↓ Blood glucose level, TC, TGs, and VLDL-C
Improved the antioxidant status (↓ MDA and ↑ thiol, SOD and CAT of renal tissue) |
(50)
|
|
Male Sprague–Dawley rats induced with 60 mg/kg STZ
|
4.0% fixed oil and 0.3% essential oil
|
8 weeks
|
↑ Insulin level and Total Antioxidant Capacity (TAC)
↓ Blood glucose level ↓ TC, LDL-C,TGs, and MDA |
(51)
|
|
Female Wistar albino rats induced with 230 mg/kg nicotinamide and 65 mg/kg STZ
|
400 mg/kg NS seed extract and 400 mg/kg NS seed fat-free methanolic extract
|
30 days
|
↓α-glucosidase enzyme of two polar lipid fractions compared with acarbose
|
(52)
|
|
Sprague–Dawley rats induced with 50 mg/kg STZ
|
2 mL/kg 5% NS aqueous extract; 0.2 mL/kg, NS oil
|
30 days
|
↓ Serum glucose
↑ Serum insulin ↓ Pancreatic tissue MDA and ↑ SOD |
(53)
|
|
Kunming mice treated with HFD for 4 weeks and a single injection of STZ
|
35, 70, and 140 mg/kg NSSP
|
4 weeks
|
↓ FBG, glycosylated serum protein, TGs, TC, LDL-C, MDA, TNF-α, IL-6, and IL-1β
↑ Insulin, HDL-C, TAC, SOD, and CAT ↑ Expression of p-AKT and GLUT4 of skeletal muscle |
(54)
|
|
Male albino rats induced with 50 mg/kg STZ
|
200 mg/kg AgNPs prepared by NS extract 200 mg/kg
|
21 days
|
↓ Glucose, AGE, and aldose reductase
↑ Insulin ↓ TNF-α, NF-κB, and S100B ↓ MDA and NO ↑ SOD and GSH ↑ Nitrotyrosine ↑ TKr A |
(55)
|
|
Male Sprague–Dawley rats induced with 65 mg/kg STZ
|
1,000 mg/kg/day Cold-pressed NS extract
|
8 weeks
|
↓ HbA1c concentration
↑ Capillary lumens ↓ Dermal capillary basement membrane thickening |
(56)
|
|
Adult female Wistar rat induced with 50 mg/kg STZ
|
0.2 mg/kg/day NS oil
|
4 weeks
|
↓ Blood glucose level
↓ Bax and Caspase-3 expression in abdominal and thoracic aortic sections |
(57)
|
|
Male Sprague–Dawley rats induced with 50 mg/kg STZ
|
2 mL/kg/day 5% NS aqueous extract 0.2 mL/kg/day NS oil and 5 mg/kg/day
|
4 weeks
|
↓ Pancreatic COX-2 enzyme, LPO, and MDA
↑ SOD |
(58)
|
|
Meriones shawi given hypercaloric food
|
48 mg/kg/day of NS ethanolic extract
|
4 weeks
|
↓ Blood glucose levels
↑ Insulin levels and improve glucose tolerance in OGTT ↑ HDL-cholesterol ↓ Liver and skeletal muscle TGs contents ↑ Skeletal muscle and liver ACC phosphorylation ↑ Skeletal muscle GLUT4 |
(59)
|
|
Sprague–Dawley rats
|
2 g/kg/day aqueous extract of NS
|
6 weeks
|
Improved body weight
↑ Inhibition of sodium-dependent glucose transport across isolated rat jejunum ↑ Glucose tolerance as efficiently as metformin in OGTT |
(60)
|
|
Male Wistar albino rats induced with 55 mg/kg STZ
|
300 mg/kg/day ethanol extract of NS
|
4 weeks
|
↓ Blood glucose levels
↑ Insulin levels ↑ TBARS, hydroperoxides, CAT, and SOD levels ↓ Glutathione and glutathione peroxidase in the liver and kidney |
(61)
|
|
Male Wistar albino rats induced with 50 mg/kg STZ
|
0.2 mL/kg/day NS volatile oil
|
4 weeks
|
↓ Pancreatic tissue MDA, serum NO
↑ SOD, GSH-Px, and CAT ↑ Insulin immunoreactive β-cell |
(62)
|
|
Male Wistar rats induced with 50 mg/kg STZ
|
0.2 mL/kg/day NS volatile oil
|
4 weeks
|
↓ Blood glucose levels
↑ Insulin levels ↑ Number of insulin-immunoreactive β-cells |
(63)
|
|
Wistar albino rats induced with 150 mg/kg of alloxan (i.p.)
|
125 and 250 mg/kg/day NS ethanolic extracts
|
4 weeks
|
↓ Serum glucose and MDA levels
↑ SOD and GSHPx ↑ Diameter and amount of Langerhans islet cells ↑ Pancreas regeneration activity |
(64)
|
|
Long Evans rats induced with 90 mg/kg STZ in vitro-isolated islets
|
NS seed methanolic extracts
|
In vivo and in vitro
|
↓ Post-prandial glucose and disaccharidase enzyme activity
↑ Glucose tolerance, GI motility and acute oral sucrose load assay Delayed glucose absorption |
(65)
|
|
In vitro-isolated pancreatic islets from male Wistar albino rats
|
NS defatted and subfraction extracts
|
In vitro
|
↑ Glucose-induced insulin release from the pancreatic β-cells (highest in basic subfraction of the NS)
|
(66)
|
|
α-Glucosidase and α-amylase assay
|
NS seed extracts
|
In vitro
|
↓ Intestinal α-glucosidase and pancreatic α-amylase activity (highest in acetone fraction of the NS)
The fraction with highest inhibitory activities are rich in apigenin and gallic acid |
(67)
|
|
Albino mice and Wistar rats induced by 140 mg/kg alloxan
|
NS
|
In vitro, in vivo, and in situ
|
↓α-amylase activity and intestinal glucose absorption
|
(68)
|
|
α-Glucosidase and α-amylase assay
|
NS AuNPs
|
In vitro
|
↑ Antioxidant activity by DPPH assay
↓α-amylase and α-glucosidase activities |
(27)
|
|
α-Glucosidase and α-amylase assay
|
NS AgNPs
|
In vitro
|
↑ Inhibition of carbohydrate-hydrolysing enzymes, such as α-amylase, α-glucosidase, and DPP-IV
|
(69)
|
표 2
생체 내 및 시험관 내 연구 에서 DM과 그 합병증에 대한 NS의 영향 요약 .
|
당뇨병 동물모델/ 체외
|
치료 복용량
|
연구 기간
|
연구 결과/주요 결과
|
참고자료
|
|
50 mg/kg STZ로 유도된 암컷 Wistar 쥐
|
0.2mg/kg/일 NS 오일
|
30 일
|
↓ 혈당 수치, 혈청 총 산화 상태(TOS) 및 MDA
↑ SOD 및 총 항산화 상태(TAS) |
( 34 )
|
|
45 mg/kg STZ로 유도된 암컷 Wistar 쥐
|
400mg/kg NS 오일
|
21일
|
↓ 혈당 수치; 심장 보호 효과 입증
↓ 근염, 유리질 변성, 젠커 괴사 ↑ Bcl-2 발현 |
( 35 )
|
|
55 mg/kg STZ로 유도된 성체 암컷 Wistar 쥐
|
2mL/kg NS 오일
|
10주
|
↓ 알부민뇨와 신장 중량/체중 비율
↑ 포도신(족세포 특이적 마커) ↓ 콜라겐 IV, TGF-β1, VEGF-A |
( 36 )
|
|
60mg/kg STZ로 유도된 성체 수컷 Wistar 쥐
|
1mL/kg NS 오일
|
이주
|
↓ 심장 및 뇌 산화질소(NO) 및 MDA
↑ GST, GSH, CAT 및 혈청 CK-MB 복원된 노르에피네프린, 도파민 및 세로토닌 |
( 37 )
|
|
230 mg/kg 니코틴아미드 및 65 mg/kg STZ로 유도된 수컷 시리아 햄스터
|
400mg/kg NS 오일
|
4 주
|
↓ 혈당
↑ 인슐린 수치, ↑ 췌장 인슐린 면역 반응성 % |
( 38 )
|
|
65 mg/kg STZ로 유도된 햄스터
|
400mg/kg NS 오일
|
4 주
|
↓ 혈당 수치 및 HbA1c
↓ 포도당 생성 전구체(알라닌, 글리세롤 및 젖산염)와의 배양에 반응하여 분리된 간세포에서 포도당 생성 ↑ 복막 대식세포의 식세포 활성 및 식세포 지수 및 말초 혈액 내 림프구 수 |
( 39 )
|
|
75 mg/kg STZ로 유도된 Wistar 쥐
|
400mg/kg/일 NS 오일 및 TQ
|
6주
|
↓ 혈당 수치는 인슐린 분비 자극과 평행하지 않음
|
( 40 )
|
|
2주 동안 HFD 및 35mg/kg STZ로 치료한 수컷 Wistar 알비노 쥐
|
2mL/kg NS 오일
|
21일
|
↓ 뇌 TBARS, NO 및 XO; ↑ GSH, GPx, GST 및 SOD
↓ 혈청 및 뇌 TNF-α, IL-6, IL-1β, iNOS NFκ-Bp65 및 AGE ↓ AChE(콜린성 기능 표지) ↓ IDE에 의한 Aβ-42 제거 ↑ GSK-3β 수준 ↓ APP, BACE1, RAGEs, p53 및 NF-κBp65 ↑ BDNF, SIRT1, ADAM10 유전자 발현 ↑ IR, PI3K, IRS1-pTyr612, AKT1-pSer473 및 GSK-3β-pSer9 |
( 41 )
|
|
2주 동안 HFD 및 35mg/kg STZ로 치료한 수컷 알비노 Sprague-Dawley 쥐
|
100mg/kg NS 오일
|
21일
|
↑ 인슐린 수용체 발현, 인슐린 유사 성장 인자-1(IGF-1) 및 포스포이노시티드-3 키나제(PI3K)
↓ ADAM-17, 혈당 수치, 지질 프로필, TBARS, NO, 혈청 인슐린/인슐린 수용체 비율 및 TNF- α |
( 42 )
|
|
45mg/kg STZ로 유도된 성체 수컷 Wistar 쥐
|
2mL/kg NS 오일
|
30 일
|
↓ FBG
↑ 인슐린 수치, ↑ 췌장 및 간 CAT 및 GSH, ↑ 인슐린 면역반응성 % 및 평균 췌도 직경 ↑ 지질 프로필 |
( 43 )
|
|
150mg/kg 10% 알록산으로 유도된 뉴질랜드 수컷 토끼
|
20 mL/kg NS 종자 수성 추출물
|
2 개월
|
↓ 포도당 및 MDA 농도
↑ GSH 및 세룰로플라스민 농도 ↓ LPO로 인한 간 손상 |
( 44 )
|
|
50mg/kg STZ로 유도된 암컷 Wistar 알비노 쥐
|
0.2mL/kg NS 휘발성 오일
|
4 주
|
↑ 인슐린 면역반응 부분 % 및 베타세포 수 보존 보통
↑ 과립과 함께 저하된 분비소포 증가 ↓ 베타세포 미토콘드리아 내 크리스태 소실로 파괴 |
( 45 )
|
|
60 mg/kg STZ로 유도된 수컷 Wistar 쥐
|
100, 200 및 400 mg/kg NS 종자 에탄올 추출물
|
6주
|
↓ 혈청 포도당 및 지질
↑ eNOS ↓ VCAM-1 및 LOX-1 ↓AGE 및 알도스 환원효소 수준 |
( 46 )
|
|
60 mg/kg STZ로 유도된 수컷 Wistar 쥐
|
200 및 400 mg/kg NS 하이드로알코올성 추출물
|
42일
|
↓ 혈청 포도당 수치
↓ MDA ↑ 해마의 티올 함량 |
( 47 )
|
|
200 mg/kg 알록산으로 유도된 암컷 Wistar 쥐
|
0.2g/kg NS 수성 추출물
|
6~8주
|
↓ 혈당 수치
↑ 인슐린 수치 및 HDL-C ↓ TG, TC, LDL-C 및 TBARS |
( 48 )
|
|
60mg/kg STZ로 유도된 수컷 Sprague-Dawley 쥐
|
고정 오일 4.0% 및 에센셜 오일 0.3%
|
8주
|
↑ 간 SOD, CAT
↓ NO 생성 ↑ 토코페롤 함량 및 간 효소 발현(글루타티온 퍼옥시다제 글루타티온 환원효소 및 글루타티온 전이효소) |
( 49 )
|
|
60 mg/kg STZ로 유도된 수컷 Wistar 쥐
|
200 및 400 mg/kg NS 하이드로알코올성 추출물
|
6주
|
↓ 혈당 수치, TC, TG, VLDL-C
항산화 상태 개선 (↓ 신장 조직의 MDA 및 ↑ 티올, SOD 및 CAT) |
( 50 )
|
|
60mg/kg STZ로 유도된 수컷 Sprague-Dawley 쥐
|
고정 오일 4.0% 및 에센셜 오일 0.3%
|
8주
|
↑ 인슐린 수치 및 총 항산화 능력(TAC)
↓ 혈당 수치 ↓ TC, LDL-C,TG 및 MDA |
( 51 )
|
|
230 mg/kg 니코틴아미드 및 65 mg/kg STZ로 유도된 암컷 Wistar 알비노 쥐
|
400 mg/kg NS 종자 추출물 및 400 mg/kg NS 종자 무지방 메탄올 추출물
|
30 일
|
↓두 극성 지질 분획의 α-글루코시다아제 효소를 아카보스와 비교
|
( 52 )
|
|
50mg/kg STZ로 유도된 Sprague-Dawley 쥐
|
2mL/kg 5% NS 수성 추출물; 0.2mL/kg, NS 오일
|
30 일
|
↓ 혈청 포도당
↑ 혈청 인슐린 ↓ 췌장 조직 MDA 및 ↑ SOD |
( 53 )
|
|
4주 동안 HFD로 치료하고 STZ를 1회 주사한 Kunming 마우스
|
35, 70, 140mg/kg NSSP
|
4 주
|
↓ FBG, 당화된 혈청 단백질, TGs, TC, LDL-C, MDA, TNF-α, IL-6 및 IL-1β ↑
인슐린, HDL-C, TAC, SOD 및 CAT ↑ p-AKT 및 GLUT4의 발현 골격근의 |
( 54 )
|
|
50mg/kg STZ로 유도된 수컷 알비노 쥐
|
NS 추출물 200mg/kg으로 제조된 200mg/kg AgNP
|
21일
|
↓ 포도당, AGE 및 알도스 환원효소
↑ 인슐린 ↓ TNF-α, NF-κB 및 S100B ↓ MDA 및 NO ↑ SOD 및 GSH ↑ 니트로티로신 ↑ TKr A |
( 55 )
|
|
65mg/kg STZ로 유도된 수컷 Sprague-Dawley 쥐
|
1,000 mg/kg/day 냉압착 NS 추출물
|
8주
|
↓ HbA1c 농도
↑ 모세혈관 내강 ↓ 피부 모세혈관 기저막 비후 |
( 56 )
|
|
50mg/kg STZ로 유도된 성체 암컷 Wistar 쥐
|
0.2mg/kg/일 NS 오일
|
4 주
|
↓ 혈당 수치
↓ 복부 및 흉부 대동맥 단면의 Bax 및 Caspase-3 발현 |
( 57 )
|
|
50mg/kg STZ로 유도된 수컷 Sprague-Dawley 쥐
|
2mL/kg/일 5% NS 수성 추출물 0.2mL/kg/일 NS 오일 및 5mg/kg/일
|
4 주
|
↓ 췌장 COX-2 효소, LPO, MDA
↑ SOD |
( 58 )
|
|
메리오네스 샤위에게 고칼로리 음식 제공
|
NS 에탄올 추출물 48mg/kg/일
|
4 주
|
↓ 혈당 수치
↑ OGTT의 인슐린 수치 및 내당능 개선 ↑ HDL-콜레스테롤 ↓ 간 및 골격근 TG 함량 ↑ 골격근 및 간 ACC 인산화 ↑ 골격근 GLUT4 |
( 59 )
|
|
Sprague–Dawley 쥐
|
NS의 수성 추출물 2g/kg/일
|
6주
|
체중 개선
↑ 분리된 쥐 공장에서 나트륨 의존성 포도당 수송 억제 ↑ OGTT에서 메트포르민만큼 효율적으로 포도당 내성 |
( 60 )
|
|
55mg/kg STZ로 유도된 수컷 Wistar 알비노 쥐
|
NS의 에탄올 추출물 300 mg/kg/day
|
4 주
|
↓ 혈당 수치
↑ 인슐린 수치 ↑ TBARS, 하이드로과산화물, CAT 및 SOD 수치 ↓ 간과 신장의 글루타티온 및 글루타티온 퍼옥시다제 |
( 61 )
|
|
50mg/kg STZ로 유도된 수컷 Wistar 알비노 쥐
|
0.2mL/kg/일 NS 휘발성 오일
|
4 주
|
↓ 췌장 조직 MDA, 혈청 NO
↑ SOD, GSH-Px, CAT ↑ 인슐린 면역반응성 베타세포 |
( 62 )
|
|
50mg/kg STZ로 유도된 수컷 Wistar 쥐
|
0.2mL/kg/일 NS 휘발성 오일
|
4 주
|
↓ 혈당 수치
↑ 인슐린 수치 ↑ 인슐린 면역반응성 베타세포 수 |
( 63 )
|
|
150mg/kg의 알록산(ip)으로 유도된 Wistar 알비노 쥐
|
125 및 250mg/kg/일 NS 에탄올 추출물
|
4 주
|
↓ 혈청 포도당 및 MDA 수치
↑ SOD 및 GSHPx ↑ 랑게르한스섬 세포의 직경 및 양 ↑ 췌장 재생 활성 |
( 64 )
|
|
시험관 내 격리된 섬 에서 90 mg/kg STZ로 유도된 Long Evans 쥐
|
NS 종자 메탄올 추출물
|
생체 내 및 시험관 내
|
↓ 식후 포도당 및 이당류효소 활성
↑ 포도당 내성, GI 운동성 및 급성 경구 자당 부하 분석 지연된 포도당 흡수 |
( 65 )
|
|
수컷 Wistar 알비노 쥐로부터 시험관 내 분리된 췌장 섬
|
NS 탈지 및 분획 추출물
|
시험관 내
|
↑ 췌장 베타 세포에서 포도당 유발 인슐린 방출(NS의 기본 하위 부분에서 가장 높음)
|
( 66 )
|
|
α-글루코시다제 및 α-아밀라제 분석
|
NS씨추출물
|
시험관 내
|
↓ 장내 α-글루코시다아제 및 췌장 α-아밀라아제 활성(NS의 아세톤 분획에서 가장 높음)
억제 활성이 가장 높은 분획에는 아피게닌과 갈산이 풍부 |
( 67 )
|
|
140mg/kg 알록산으로 유도된 알비노 쥐와 Wistar 쥐
|
NS
|
시험관 내, 생체 내 및 현장 내
|
↓α-아밀라아제 활성 및 장내 포도당 흡수
|
( 68 )
|
|
α-글루코시다제 및 α-아밀라제 분석
|
NS AuNP
|
시험관 내
|
↑ DPPH 분석을 통한 항산화 활성
↓α-아밀라제 및 α-글루코시다제 활성 |
( 27 )
|
|
α-글루코시다제 및 α-아밀라제 분석
|
NS AgNP
|
시험관 내
|
↑ α-아밀라제, α-글루코시다제, DPP-IV 등 탄수화물 가수분해 효소 억제
|
( 69 )
|
- 셀 병합
- 행 분할
- 열 분할
- 너비 맞춤
- 삭제

Figure 3
Proposed antidiabetic effects of NS. NS attenuates insulin secretion by ameliorating β cell proliferation and improves the structure of the islet of the pancreas. In the small intestine, NS agents delay the digestion and absorption of food because of the inhibitory activity of α-amylase and α-glucosidase. NS also modulate SGLT causing less glucose absorption in the jejunum epithelium and activating GLUT4, which is associated with increased glucose absorption in skeletal muscle. NS also alleviates insulin resistance by activating the PI3K/Akt signaling pathway, which promotes GLUT4 biogenesis and translocation. NS also decreases hepatic gluconeogenesis by reducing its precursors. Besides, NS exerts a potential in scavenging O2−, HO·, DPPH, and other free radicals to lighten oxidative stress, resulting in the less production of malondialdehyde (MDA) and nitric oxide. NS also increase the contents and activity of antioxidant enzymes GSHPx, SOD, and CAT. NS improves dyslipidaemia, which could reduce inflammatory markers, such as IL-6, IL-1β, and TNF-α, along with the reduction of apoptosis markers, such as Bax and caspase-3.
그림 3
NS의 제안된 항당뇨 효과. NS는 β 세포 증식을 개선하여 인슐린 분비를 약화시키고 췌장도(이자섬)의 구조를 개선합니다. 소장에서 NS는 α-아밀라아제 및 α-글루코시다아제의 억제 활성으로 인해 음식물의 소화 및 흡수를 지연시킵니다. 또한 NS는 SGLT를 조절하여 공장 상피에서 포도당 흡수를 감소시키고 골격근에서 포도당 흡수 증가와 관련된 GLUT4를 활성화합니다. 또한 NS는 GLUT4 생성과 전위를 촉진하는 PI3K/Akt 신호 전달 경로를 활성화하여 인슐린 저항성을 완화합니다. 또한 NS는 전구체를 감소시켜 간 포도당 생성을 감소시킵니다. 또한, NS는 산화 스트레스를 완화하기 위해 O2-, HO-, DPPH 및 기타 자유 라디칼을 제거하여 말론디알데히드(MDA)와 산화질소 생성을 감소시키는 잠재력을 발휘합니다. 또한 NS는 항산화 효소인 GSHPx, SOD, CAT의 함량과 활성을 증가시킵니다. NS는 이상지질혈증을 개선하여 IL-6, IL-1β, TNF-α와 같은 염증 표지자를 감소시키고 Bax 및 caspase-3와 같은 세포 사멸 표지자를 감소시킬 수 있습니다.
In vitro and in vivo studies (시험관 및 생체 내 연구)
DM is a complex multifactorial metabolic disorder characterized by hyperglycaemia and lack of insulin release or insulin resistance. The pathophysiology of DM is closely associated with impaired redox homeostasis, activation of the inflammatory signaling cascade, and dyslipidaemia. Insulin, the key regulator hormone released by the β cell of the pancreas, is essential in maintaining glucose homeostasis. Hence, restoring insulin release and its sensitivity is warranted as one of the therapeutic strategies in managing DM.
당뇨병은 고혈당증과 인슐린 방출 부족 또는 인슐린 저항성을 특징으로 하는 복잡한 다인성 대사 장애입니다. 당뇨의 병태 생리학은 산화 환원 항상성 손상, 염증 신호 전달 체계의 활성화, 이상 지질 혈증과 밀접한 관련이 있습니다. 췌장의 베타 세포에서 분비되는 주요 조절 호르몬인 인슐린은 포도당 항상성을 유지하는 데 필수적입니다. 따라서 인슐린 분비 및 민감성을 회복하는 것은 당뇨병 관리의 치료 전략 중 하나입니다.
Reports from recent studies have shown NS manage to alleviate the plasma glucose level due to its insulinotropic effects. In these studies, the proposed mechanisms for this effect are through the modulation of insulin receptor genes, increasing the insulin/insulin receptor ratio (42), enhancing the brain's insulin signaling pathway (41) and increased in insulin release from the increment of β cell activity (38).
최근 연구에 따르면 NS는 인슐린 이완 효과로 인해 혈장 포도당 수치를 완화하는 것으로 나타났습니다. 이러한 연구에서 이러한 효과의 메커니즘으로 제안된 것은 인슐린 수용체 유전자 조절, 인슐린/인슐린 수용체 비율 증가(42), 뇌의 인슐린 신호 전달 경로 강화(41), β 세포 활성 증가에 따른 인슐린 방출 증가(38) 등입니다.
The potential effect of NS in promoting insulin release has been studied extensively in T2DM animal models using a combination of streptozotocin (STZ) and nicotinamide or a combination of low-dose STZ with a high-fat diet (HFD). Rchid et al. further validated these findings in their in vitro study. They found that NS can stimulate glucose-induced insulin release, which is the highest in the basic fraction compared to the acidic and neutral fractions (66). The basic fraction of NS contains amino acids and some basic compounds, which could contribute to this particular effect of NS. This result signifies that the hypoglycaemic effect of NS is partially mediated by the potentiation of insulin release by the β cell.
인슐린 분비를 촉진하는 NS의 잠재적 효과는 스트렙토조토신(STZ)과 니코틴아마이드의 조합 또는 저용량 STZ와 고지방 식이(HFD)의 조합을 사용하여 제2형 당뇨 동물 모델에서 광범위하게 연구되었습니다. Rchid 등은 체외 연구에서 이러한 결과를 추가로 검증했습니다. 그들은 NS가 포도당에 의한 인슐린 방출을 자극할 수 있으며, 이는 산성 및 중성 분획에 비해 염기성 분획에서 가장 높다는 것을 발견했습니다(66). NS의 염기성 분획에는 아미노산과 일부 염기성 화합물이 포함되어 있으며, 이는 NS의 이러한 특정 효과에 기여할 수 있습니다. 이 결과는 NS의 혈당 강하 효과가 부분적으로 β 세포에 의한 인슐린 방출의 강화에 의해 매개된다는 것을 의미합니다.
Interestingly, El-Dakhakhny et al. reported that the hypoglycaemic effect of NS is not parallel to the stimulation of insulin release. In this study, they found that NS oil and its bioactive compounds, nigellone and thymoquinone, could stimulate insulin secretion in isolated rat pancreatic islets in the presence of glucose. However, as the insulin release does not reflect the blood glucose level, they postulate that NS possesses an extrapancreatic role in causing the hypoglycaemic effect. However, in this study, they used a much higher STZ (75 mg/kg) dose to induce the experimental animal, signifying more extensive damage to the β cell, which mimics T1DM rather than T2DM, as reported in the previous study (40).
흥미롭게도 El-Dakhakhny 등은 NS의 저혈당 효과가 인슐린 방출 자극과 평행하지 않다고 보고했습니다. 이 연구에서 그들은 NS 오일과 그 생리 활성 화합물인 니겔론과 티모퀴논이 포도당이 있는 상태에서 분리된 쥐의 췌장에서 인슐린 분비를 자극할 수 있다는 것을 발견했습니다. 그러나 인슐린 방출이 혈당 수준을 반영하지 않기 때문에 연구팀은 NS가 저혈당 효과를 유발하는 데 췌장 외적인 역할을 한다고 가정합니다. 그러나 이 연구에서는 훨씬 더 높은 STZ(75 mg/kg) 용량을 사용하여 실험 동물을 유도했는데, 이는 이전 연구에서 보고된 것처럼 T2DM(제2형 당뇨병)이 아닌 T1DM(제1형 당뇨병)을 모방한 β 세포에 더 광범위한 손상이 있음을 의미합니다(40).
Pancreatic tissue are vulnerable to diabetes-induced oxidative stress due to low expression of antioxidant enzyme and high production of endogenous ROS (70). This tissue damage could further impair the insulin released, deteriorating the diabetes condition. The effect of NS ameliorating insulin release from the β cell was further supported by the improvement in the β cell histoarchitecture findings. Studies revealed that administration of NS causes an increase in insulin immunoreactive percentage and mean pancreatic islet diameter, the ability to preserve the pancreatic β cell integrity, and increased area of insulin immunoreactive β cells in diabetic rats (43, 53). Additionally, Kanter et al. reported that treatment with 0.2 mL NS volatile oil for 4 weeks could lead to partial regeneration or proliferation of the pancreatic β cells in STZ-induced female diabetic rats (45). These improvements in β cell structure and functions could restore insulin release, which helps in overall blood glucose control in both T1DM and T2DM.
췌장 조직은 항산화 효소의 발현이 낮고 내인성 ROS(70)가 많이 생성되기 때문에 당뇨병으로 인한 산화 스트레스에 취약합니다. 이러한 조직 손상은 인슐린 분비를 더욱 저해하여 당뇨병 상태를 악화시킬 수 있습니다. NS가 β 세포에서 인슐린 방출을 개선하는 효과는 β 세포 조직 구조의 개선으로 더욱 뒷받침되었습니다. 연구에 따르면 NS를 투여하면 당뇨병 쥐에서 인슐린 면역 반응 비율과 평균 췌장도(이자섬) 직경, 췌장 β 세포 완전성 보존 능력, 인슐린 면역 반응 β 세포의 면적이 증가하는 것으로 나타났습니다(43, 53). 또한 Kanter 등은 0.2mL NS 휘발성 오일을 4주 동안 처리하면 STZ로 유도한 암컷 당뇨병 쥐의 췌장 베타 세포가 부분적으로 재생 또는 증식할 수 있다고 보고했습니다(45). 이러한 β 세포 구조와 기능의 개선은 인슐린 방출을 회복시켜 제1형 당뇨병과 제2형 당뇨병 모두에서 전반적인 혈당 조절에 도움이 될 수 있습니다.
The hypoglycaemic effect seen in NS could also be attributed to the role of glucose transport. In a study by Meddah et al., 2 g/kg/day NS extract caused a reduction in glucose reabsorption from the intestine by modulating SGLT1, the primary glucose transporter in the intestine (60). The inhibition of SGLT1 not only improves glucose absorption but can also induce the release of incretin, such as glucagon-like peptide (GLP-1), which augments glucose-induced insulin secretion and prevents the release of glucagon (71). Thus, by acting on SGLT1, NS could help maintain blood glucose homeostasis. Normally, insulin facilitates glucose uptake in skeletal muscle and adipocytes through GLUT4 activity. The translocation of the GLUT4 to the cell surface helps in glucose transport into the cell, which reflects insulin sensitivity (72). In diabetes, the normal harmony between GLUT4 and insulin activity is disrupted. The prolonged hyperinsulinemia and hyperglycaemia worsen insulin resistance, which causes the glucose to be unable to enter the cell. Administration of 48 mg/kg/day of NS ethanolic extract in STZ-induced diabetes rats for 4 weeks shows upregulation in GLUT4 activity and synthesis in the skeletal muscle. This finding corresponds to the other parameter, such as improvement in blood glucose level, insulin and glucose tolerance following NS treatment.
NS에서 나타나는 저혈당 효과는 포도당 수송의 역할에 기인할 수도 있습니다. Meddah 등의 연구에 따르면, 하루 2g/kg/일의 NS 추출물은 장에서 포도당 재흡수를 감소시켰으며, 이는 장의 주요 포도당 수송체인 SGLT1을 조절하여 포도당 재흡수를 감소시켰습니다(60). SGLT1의 억제는 포도당 흡수를 개선할 뿐만 아니라 포도당에 의한 인슐린 분비를 증가시키고 글루카곤의 분비를 억제하는 글루카곤 유사 펩타이드(GLP-1)와 같은 인크레틴의 방출을 유도할 수 있습니다(71). 따라서 NS는 SGLT1에 작용하여 혈당 항상성을 유지하는 데 도움을 줄 수 있습니다. 일반적으로 인슐린은 GLUT4 활성을 통해 골격근과 지방 세포에서 포도당 흡수를 촉진합니다. GLUT4가 세포 표면으로 전위되면 세포 내 포도당 수송에 도움이 되며, 이는 인슐린 민감성을 반영합니다(72). 당뇨병에서는 GLUT4와 인슐린 활동 사이의 정상적인 조화가 깨집니다. 고인슐린 혈증과 고혈당증이 장기간 지속되면 인슐린 저항성이 악화되어 포도당이 세포에 들어갈 수 없게 됩니다. STZ로 유도한 당뇨병 쥐에 하루 48mg/kg의 NS 에탄올 추출물을 4주 동안 투여한 결과 골격근에서 GLUT4 활성과 합성이 상향 조절된 것으로 나타났습니다. 이 발견은 NS 치료 후 혈당 수치, 인슐린 및 내당능 개선과 같은 다른 매개 변수와 일치합니다.
Hypolipidemic effects In diabetes, hyperglycaemia cause reduction in lipoprotein lipase activity which leads to hyperlipidaemia (73). Diabetic dyslipidaemia, characterized by increased fasting and post-prandial blood glucose, low-density lipoprotein (LDL-C), and decreased high-density lipoprotein (HDL-C), represents the major link with increased cardiovascular risk of diabetic patients (74). Fat accumulation has also been linked to systemic oxidative stress in animal and human studies due to the generation of inflammation and oxidative stress. NS has been shown to cause improvement in dyslipidaemia and high blood glucose levels in various diabetes studies. A study by Bensiameur-Touati et al. reported that the supplementation of 0.2 g/kg NS improved dyslipidaemia in diabetic rats by increasing the HDL-C and decreasing the triglycerides (TGs), cholesterol and low-density lipoprotein (LDL-C) (48). This finding is supported by Mohebbati et al. as they found administration of NS hydroalcoholic extracts for 6 weeks decreased TC, TGs, and VLDL-C (50). The essential fatty acid content in the NS itself could be among the factors that augment the improvement of dyslipidemia and its complications (75). Interestingly, utilization of NS seed polysaccharide also revealed similar improvement in lipid profile following treatment for 4 weeks in the T2DM rat model (54).
당뇨병에서 고지혈증 효과, 고혈당증은 지단백질 리파아제 활성을 감소시켜 고지혈증을 유발합니다(73). 공복 및 식후 혈당, 저밀도 지단백질(LDL-C) 증가, 고밀도 지단백질(HDL-C) 감소를 특징으로 하는 당뇨병성 이상지질혈증은 당뇨병 환자의 심혈관 위험 증가와 주요 연관성을 나타냅니다(74). 지방 축적은 염증과 산화 스트레스의 생성으로 인해 동물 및 인간 연구에서 전신 산화 스트레스와도 관련이 있는 것으로 나타났습니다. NS는 다양한 당뇨병 연구에서 이상지질혈증과 고혈당 수치를 개선하는 것으로 나타났습니다. 벤시아메르-투아티(Bensiameur-Touati) 등의 연구에 따르면 0.2g/kg NS를 보충하면 당뇨병 쥐의 이상지질혈증이 HDL-C를 증가시키고 중성지방(TG), 콜레스테롤 및 저밀도 지단백질(LDL-C)을 감소시켜 개선된다고 보고했습니다(48). Mohebbati 등은 6주 동안 NS 하이드로알코올 추출물을 투여하면 TC, TG 및 VLDL-C가 감소한다는 사실을 발견하여 이러한 결과를 뒷받침했습니다(50). NS 자체의 필수 지방산 함량은 이상지질혈증과 그 합병증 개선을 강화하는 요인 중 하나 일 수 있습니다 (75). 흥미롭게도 NS 종자 다당류의 활용은 T2DM 쥐 모델에서 4주 동안 치료한 후 지질 프로필이 유사하게 개선된 것으로 나타났습니다(54).
Antioxidants effects (항산화제의 효과)
Hyperglycaemia control remains one of the focal therapeutic strategies in managing DM. Uncontrol chronic hyperglycaemia triggers the overactivity of the NADPH oxidase enzyme, increases adipocyte expansion and mitochondrial production of the reactive oxygen species (ROS). When the production of ROS supersedes the antioxidant activity, it will result in the formation of oxidative stress (76).
항산화제의 효과 고혈당 조절은 당뇨병 관리의 핵심 치료 전략 중 하나입니다. 조절되지 않는 만성 고혈당증은 NADPH 산화 효소의 과잉 활동을 유발하고 지방 세포 확장 및 미토콘드리아에서 활성 산소 종(ROS)의 생성을 증가시킵니다. 활성산소(ROS)의 생성이 항산화 활성을 대체하면 산화 스트레스가 형성됩니다(76).
A plethora of studies have proven NS's pharmacological potential is mainly due to its antioxidant property. As a potential source of antioxidants, NS is shown to cause a reduction in ROS formation and lipid peroxidation (LPO), evidenced by a decrease in its by-product, malondialdehyde (MDA). NS also upregulates the activity of the antioxidant enzymes such as catalase (CAT), superoxide dismutase (SOD), glutathione peroxidase (GPx), or molecules such as glutathione (GSH) in both in vitro and in vivo studies, which include both serum and the target tissue.
수많은 연구를 통해 NS의 약리학적 잠재력은 주로 항산화 특성 때문이라는 사실이 입증되었습니다. 항산화제의 잠재적 공급원인 NS는 부산물인 말론다이알데히드(MDA)의 감소로 입증된 것처럼 ROS 형성과 지질 과산화(LPO)를 감소시키는 것으로 나타났습니다. 또한 NS는 혈청과 표적 조직을 모두 포함하는 시험관 및 생체 내 연구에서 카탈라아제(CAT), 슈퍼옥사이드 디스뮤타제(SOD), 글루타치온 퍼옥시다제(GPx) 또는 글루타치온(GSH)과 같은 항산화 효소의 활동을 상향 조절하는 것으로 나타났습니다.
Seflek et al. reported treatment with 0.2 mg NS oil daily for 30 days caused a significant reduction in total oxidant status (TOS) and MDA and an increase in the antioxidant enzyme, SOD, along with total antioxidant status (TAS) in STZ-induced rats (34). Similar findings have been reported in a study on diabetic myopathy. They found that administration of 1 mL/kg NS oil restores the antioxidant enzyme such as CAT, GSH, GST, and cardiac enzyme CK-MB and reduces the MDA level, which signifies the improvement of the oxidant balance (37). Balbaa et al. further supported this finding in their study using the T2DM animal model, which they reported a significant reduction in brain oxidative stress evidenced by a decrease in TBARS whilst increasing the GSH, GPx, GST, and SOD (41). They also found the NS administration for 21 days able to deplete one of the crucial enzymes in generating oxidative stress, xanthine oxidase (XO). XO utilized xanthine and hypoxanthine as reducing substrates and causes electron reduction of an oxygen molecule to yield ROS such as superoxide and hydrogen peroxidase (77). Thus, ROS generation can be controlled and minimized by lowering the XO activity. Another critical finding in this study is the NS potential in reducing the advanced glycation end products (AGE). AGE formed by the non-enzymatic reaction secondary to chronic hyperglycaemia propagates the oxidative stress reaction by activation of NADPH oxidase enzyme and increases the drive of mitochondrial ROS production (78). Similarly, Abbasnezhad et al. also reported a reduction in AGE following treatment for 6 weeks in STZ-induced rats (46).
Seflek 등은 30일 동안 매일 0.2 mg NS 오일을 투여한 결과 STZ로 유도한 쥐에서 총 산화 상태(TOS)와 MDA가 현저히 감소하고 항산화 효소인 SOD와 총 항산화 상태(TAS)가 증가했다고 보고했습니다(34). 당뇨병성 근병증에 대한 연구에서도 비슷한 결과가 보고되었습니다. 연구진은 1mL/kg의 NS 오일을 투여하면 항산화 효소인 CAT, GSH, GST 및 심장 효소인 CK-MB가 회복되고 산화 균형이 개선되었음을 의미하는 MDA 수치가 감소한다는 사실을 발견했습니다(37). Balbaa 등은 T2DM 동물 모델을 사용한 연구에서 이러한 결과를 뒷받침하는 추가 연구를 수행했으며, 이 연구에서는 GSH, GPx, GST 및 SOD를 증가시키면서 TBARS의 감소로 입증된 뇌 산화 스트레스의 현저한 감소를 보고했습니다(41). 또한 21일 동안 NS를 투여하면 산화 스트레스를 생성하는 데 중요한 효소 중 하나인 크산틴 산화효소(XO)가 고갈되는 것을 발견했습니다. XO는 크산틴과 하이폭산틴을 환원 기질로 사용하며 산소 분자의 전자 환원을 일으켜 슈퍼옥사이드 및 과산화수소(77)와 같은 ROS를 생성합니다. 따라서 XO 활성을 낮춤으로써 ROS 생성을 제어하고 최소화할 수 있습니다. 이 연구에서 또 다른 중요한 발견은 NS가 진행성 당화 최종 산물(AGE)을 감소시킬 수 있는 잠재력이 있다는 것입니다. 만성 고혈당증에 이차적으로 비효소 반응에 의해 형성된 AGE는 NADPH 산화 효소의 활성화에 의해 산화 스트레스 반응을 전파하고 미토콘드리아 ROS 생성의 추진력을 증가시킵니다(78). 이와 유사하게, 아바스네자드(Abbasnezhad) 등은 STZ로 유도된 쥐에서 6주 동안 치료한 후 AGE가 감소했다고 보고했습니다(46).
In a more recent study, Alkhalaf et al. utilized the NS extract to synthesize the silver nanoparticles (AgNPs) and reported their antioxidant potential in reducing of both AGE and MDA (55). The study that ran for 21 days in STZ-induced rats also reported an increase in the antioxidant enzymes, SOD and GSH along with an increase in nitrotyrosine. The liver and kidney also benefit from the antioxidant effects of the NS as they cause an increase in TBARS, hydroperoxides, CAT and SOD levels and reduced glutathione and glutathione peroxidase following treatment with 300 mg/kg/day ethanol extract of NS for 4 weeks (61). A similar antioxidant potential is reported in the NS gold nanoparticle, which increased the antioxidant activity in the DPPH assay (27).
더 최근의 연구에서 알칼라프(Alkhalaf) 등은 NS 추출물을 활용하여 은나노입자(AgNP)를 합성한 결과, 은나노입자의 항산화 잠재력이 AGE와 MDA를 모두 감소시킨다고 보고했습니다(55). STZ로 유도한 쥐를 대상으로 21일간 진행된 연구에서도 항산화 효소인 SOD와 GSH의 증가와 함께 니트로티로신의 증가가 보고되었습니다. 간과 신장도 NS의 항산화 효과의 혜택을 받는데, 4주 동안 NS의 에탄올 추출물을 300 mg/kg/일 처리한 결과 TBARS, 하이드로페록사이드, CAT 및 SOD 수치가 증가하고 글루타치온과 글루타치온 퍼옥시다아제가 감소한 것으로 나타났습니다(61). NS 금 나노입자에서도 유사한 항산화 잠재력이 보고되었으며, 이는 DPPH 분석에서 항산화 활성을 증가시켰습니다(27).
A comparison study between NS oil and the NS aqueous on the pancreas reported that both NS preparation protects against oxidative stress by decreasing COX-2, LPO, and MDA and increasing the antioxidant enzyme SOD, hence, providing pancreatic-protective effects. However, treatment with NS oil could not ameliorate the serum glucose level to normal value despite restoring the insulin level in diabetic rats (58). In another study, hydroalcoholic extracts of NS with doses of 200 and 400 mg/kg for 42 days were shown to improve oxidative status by increasing the thiol content and decreasing the MDA level in the hippocampus of diabetic rats (47).
췌장에 대한 NS 오일과 NS 수용액의 비교 연구에 따르면 두 NS 제제 모두 COX-2, LPO 및 MDA를 감소시키고 항산화 효소 SOD를 증가시켜 산화 스트레스로부터 보호하여 췌장 보호 효과를 제공한다고 보고했습니다. 그러나 NS 오일로 치료하면 당뇨병 쥐의 인슐린 수치가 회복되었음에도 불구하고 혈청 포도당 수치를 정상 수치로 개선하지 못했습니다 (58). 또 다른 연구에서는 42일 동안 200 및 400 mg/kg 용량의 NS 하이드로알코올 추출물이 당뇨병 쥐의 해마에서 티올 함량을 증가시키고 MDA 수준을 감소시킴으로써 산화 상태를 개선하는 것으로 나타났습니다(47).
Anti-inflammatory effects (항염증 효과)
Diabetes induced-oxidative damage may create ripple effects that trigger widespread inflammatory reactions, which further exacerbate the damage to the tissues. Studies have shown that the pro-inflammatory molecules such as interleukin 6 (IL-6), interleukin-1beta (IL-1β), and tumor necrosis factor (TNF-α) are significantly elevated in diabetic humans and experimental models (79). Furthermore, these pro-inflammatory markers serve a crucial role in metabolic inflammation caused by the impairment of serine phosphorylation of insulin receptor substrate 1 (IRS-1), which regulates insulin receptor signaling and consequently modulates insulin action (80).
당뇨병으로 인한 산화 손상은 광범위한 염증 반응을 유발하는 파급 효과를 일으켜 조직 손상을 더욱 악화시킬 수 있습니다. 연구에 따르면 당뇨병 환자와 실험 모델에서 인터루킨 6(IL-6), 인터루킨-1베타(IL-1β), 종양 괴사인자(TNF-α)와 같은 전 염증성 분자가 유의미하게 증가합니다(79). 또한 이러한 전 염증성 마커는 인슐린 수용체 신호를 조절하고 결과적으로 인슐린 작용을 조절하는 인슐린 수용체 기질 1(IRS-1)의 세린 인산화 손상으로 인한 대사성 염증에 중요한 역할을 합니다(80).
Studies have reported that IL-1β, IL-6, and TNF-α were significantly reduced in the serum of HFD-STZ-induced diabetic rats treated with NS seed polysaccharides (NSSP) for 4 weeks (54). This may relate to the NS potential to significantly downregulate the gene and protein expression of inflammatory chemokines, as well as repress the activation of NFκB and MAPK pathways, which are crucial for cellular inflammatory responses (76). The green synthesis of silver nanoparticles (SeNPs) using NS seed extract also revealed similar effects in causing a reduction in the TNF-α and NFκB in diabetic nephropathy animal models (55). The generation of the massive pro-inflammatory cytokines further exacerbates the inflammatory reaction, which could potentiate insulin resistance by altering the insulin signaling pathways. NS administration was shown to reverse these effects by upregulating the gene expression of insulin growth factor 1 (IGF-1) and phosphoinositide-3 kinase (PI3K) (42). The increase in IGF-1 and PI3K helps promote insulin sensitivity which is crucial in maintaining blood glucose control, particularly in T2DM.
연구에 따르면 4주 동안 NS 종자 다당류(NSSP)로 처리한 HFD-STZ 유도 당뇨병 쥐의 혈청에서 IL-1β, IL-6, TNF-α가 유의하게 감소한 것으로 보고되었습니다(54). 이는 NS가 염증성 케모카인의 유전자 및 단백질 발현을 현저히 하향 조절하고 세포 염증 반응에 중요한 NFκB 및 MAPK 경로의 활성화를 억제할 수 있는 잠재력과 관련이 있을 수 있습니다(76). NS 종자 추출물을 이용한 은나노입자(SeNP)의 녹색 합성 또한 당뇨병성 신증 동물 모델에서 TNF-α와 NFκB를 감소시키는 유사한 효과를 나타냈습니다(55). 대량의 염증성 사이토카인이 생성되면 염증 반응이 더욱 악화되어 인슐린 신호 경로를 변경함으로써 인슐린 저항성을 강화할 수 있습니다. NS 투여는 인슐린 성장 인자 1(IGF-1)과 포스포이노시타이드-3 키나아제(PI3K)의 유전자 발현을 상향 조절하여 이러한 효과를 반전시키는 것으로 나타났습니다(42). IGF-1과 PI3K의 증가는 인슐린 감수성을 촉진하는 데 도움이 되며, 이는 특히 제2형 당뇨병에서 혈당 조절을 유지하는 데 중요한 역할을 합니다.
Vascular inflammation is another critical issue, which causes a high chance of morbidity and mortality in diabetic patients. Insulin resistance disrupted nitric oxide synthesis by reducing the activity of endothelial NO synthase (eNOS) along with increased production of a vasoconstrictor such as endothelin-1 (81). NS was found to reverse this effect by increasing the eNOS, which helps improve endothelial dysfunction (46). They also reported that NS treatment with ethanolic extracts for 6 weeks caused a reduction in vascular cell adhesion molecule 1 (VCAM-1), mainly used to allow firm adhesion of leukocytes to endothelial cells and promotes vascular inflammation (82). A previous study reported that NS bioactive compound thymoquinone disrupts the link between TNF- α signaling pathway that regulates the ICAM/VCAM expression in arthritis in vitro (83). This means that NS mediates its effects by modulating the adhesion molecule as well as controlling the inflammatory markers.
혈관 염증은 당뇨병 환자의 이환율과 사망률을 높이는 또 다른 중요한 문제입니다. 인슐린 저항성은 엔도텔린-1과 같은 혈관 수축 물질의 생산 증가와 함께 내피 NO 합성 효소(eNOS)의 활성을 감소시켜 산화질소 합성을 방해합니다(81). NS는 내피 기능 장애를 개선하는 데 도움이 되는 eNOS를 증가시킴으로써 이러한 효과를 역전시키는 것으로 밝혀졌습니다(46). 또한 에탄올 추출물로 6주 동안 NS를 처리하면 주로 백혈구가 내피 세포에 단단히 부착하고 혈관 염증을 촉진하는 데 사용되는 혈관 세포 부착 분자 1(VCAM-1)이 감소한다고 보고했습니다(82). 이전 연구에 따르면 NS 생리활성 화합물 티모퀴논은 시험관 내에서 관절염에서 ICAM/VCAM 발현을 조절하는 TNF-α 신호 전달 경로 사이의 연결을 방해한다고 보고했습니다(83). 이는 NS가 접착 분자를 조절하고 염증 마커를 조절하여 그 효과를 매개한다는 것을 의미합니다.
Interestingly, Balbaa et al. reported that the combination of NS oil and hypoglycaemic drugs such as metformin and glibenclamide inhibited the inducible nitric oxide synthase (iNOS) and NO formation in the brain tissue (41). As iNOS is considered one of the important regulators for insulin resistance, its inhibition minimizes the risk of disease progression. In an earlier study, Balbaa et al. also revealed a reduced serum NO in T2DM rats (42). Similarly, Hamdy and Taha also reported a significant reduction in NO levels in both heart and brain samples (37). Nitric oxide works like double edge swords, yielding different outcomes in various studies. The lack of NO leads to vascular damage by causing endothelial dysfunction, as mentioned earlier, and NO in excess causes the propagation of oxidative stress and inflammation. Hence, the NS's ability to restore NO homeostasis is warranted in managing DM.
흥미롭게도 Balbaa 등은 NS 오일과 메트포르민 및 글리벤클라미드와 같은 혈당 강하제를 병용하면 뇌 조직에서 유도성 산화질소 합성효소(iNOS)와 NO 형성이 억제된다고 보고했습니다(41). iNOS는 인슐린 저항성의 중요한 조절인자 중 하나로 간주되므로 이를 억제하면 질병 진행의 위험을 최소화할 수 있습니다. 이전 연구에서 Balbaa 등은 제2형 당뇨병 쥐에서 혈청 NO가 감소한다는 사실을 밝혀냈습니다(42). 마찬가지로 Hamdy와 Taha도 심장 및 뇌 샘플 모두에서 NO 수치가 현저히 감소했다고 보고했습니다(37). 산화질소는 양날의 검처럼 작용하여 다양한 연구에서 서로 다른 결과를 낳습니다. 산화질소가 부족하면 앞서 언급한 것처럼 내피 기능 장애를 일으켜 혈관 손상을 일으키고, 산화질소가 과도하면 산화 스트레스와 염증을 유발합니다. 따라서 당뇨병을 관리할 때 NO 항상성을 회복하는 NS의 능력은 반드시 필요합니다.
Anti-apoptotic effects (항세포사멸 효과 )
The abundance generation of ROS and pro-inflammatory cytokines opens the gate for the activation of the apoptosis cascade and leakage of cytochrome-c, which lead to more detrimental effects. The extrinsic apoptotic pathway is initiated by binding the Fas ligand to the death receptor to activate the caspase complex. Whereas, the intrinsic apoptotic pathway is derived from the regulated B-cell lymphoma (BCL-2), which expresses both pro- and anti-apoptotic signals (84). In response to apoptotic stimuli, upregulation of BCL-2-associated X protein (BAX) and downregulation of BCL2 and has reported promoting cell death in diabetic models (85).
ROS와 염증성 사이토카인의 풍부한 생성은 세포사멸 캐스케이드의 활성화와 사이토크롬-c의 누출을 위한 문을 열어 더 해로운 영향을 미칩니다. 외인성 세포 사멸 경로는 Fas 리간드가 사멸 수용체에 결합하여 카스파제 복합체를 활성화함으로써 시작됩니다. 반면, 내재적 세포 사멸 경로는 세포 사멸 신호와 항세포 사멸 신호를 모두 발현하는 조절된 B세포 림프종(BCL-2)에서 유래합니다(84). 세포 사멸 자극에 대한 반응으로 BCL-2 관련 X 단백질(BAX)의 상향 조절과 BCL2의 하향 조절이 당뇨병 모델에서 세포 사멸을 촉진하는 것으로 보고되었습니다(85).
NS significantly increases the expression BCL2 in cardiac tissue following NS oil administration for 21 days (35). Cuce et al. also found a similar result as they reported a reduction in BAX and caspase 3 expression in the abdominal and thoracic aortic section, preventing apoptosis in the vessels of STZ-induced diabetic rats (57). The antiapoptotic effect of NS is not only beneficial for preventing cellular damage in DM but also resourceful in managing cancerous cells, as reported widely (86). These studies highly suggest that NS treatment could modulate both the intrinsic and extrinsic pathways of hyperglycaemia-induced cell death.
NS는 21일 동안 NS 오일을 투여한 후 심장 조직에서 BCL2의 발현을 유의하게 증가시켰습니다(35). Cuce 등은 복부 및 흉부 대동맥 섹션에서 BAX 및 카스파제 3 발현이 감소하여 STZ 유도 당뇨병 쥐의 혈관에서 세포 사멸을 방지한다고 보고하면서 유사한 결과를 발견했습니다(57). NS의 항세포사멸 효과는 당뇨병의 세포 손상을 예방하는 데 도움이 될 뿐만 아니라 암세포를 관리하는 데도 유용하다는 사실이 널리 보고되었습니다(86). 이러한 연구는 NS 치료가 고혈당증에 의한 세포 사멸의 내재적 및 외재적 경로를 모두 조절할 수 있음을 강력히 시사합니다.
Hepatoprotective effects (간 보호 효과)
Hyperglycaemia and insulin resistance in DM affect the carbohydrates, fats and protein metabolism, potentially leading to the formation of non-alcoholic fatty liver disease. If there is no proper intervention, there is a risk of progression to hepatitis, cirrhosis, and eventually hepatocellular carcinoma (87). Among the main triggers responsible for this deteriorating effect are oxidative stress and liver inflammation. Various studies have reported that high lipid peroxidation (LPO) could damage the hepatocyte, characterized by raised liver enzyme and alteration of the histoarchitecture of the liver (78). Administration of the NS oil for 30 days improved hepatic antioxidant enzymes such as CAT and GSH while preventing the LPO in the liver of STZ-induced rats (43).
당뇨병 환자의 고혈당증과 인슐린 저항성은 탄수화물, 지방 및 단백질 대사에 영향을 미쳐 잠재적으로 비알코올성 지방간 질환을 일으킬 수 있습니다. 적절한 개입이 없으면 간염, 간경변, 결국 간세포 암종으로 진행될 위험이 있습니다(87). 이러한 악화 효과를 일으키는 주요 유발 요인 중에는 산화 스트레스와 간 염증이 있습니다. 다양한 연구에 따르면 높은 지질 과산화(LPO)는 간 효소 상승과 간 조직 구조의 변화를 특징으로 하는 간세포를 손상시킬 수 있다고 보고되었습니다(78). NS 오일을 30일간 투여하면 STZ로 유도한 쥐의 간에서 LPO를 예방하면서 CAT 및 GSH와 같은 간 항산화 효소가 개선되었습니다(43).
Similar hepatoprotective effects were shown by Kaleem et al. using NS ethanol extract treatment for 4 weeks (61). They found that 300 mg/kg NS ethanol extract improved the antioxidant enzymes, such as CAT, SOD, and LPO products [thiobarbituric acid reactive substance (TBARS) and hydroperoxides] and reduced glutathione (GSH) and glutathione peroxidase (GSHPx) in both liver and kidney (61) of STZ-induced rats. Interestingly, a study on alloxan-induced rabbits also demonstrated improved GSH and ceruloplasmin concentrations whilst preventing LPO-induced liver damage in diabetic rabbits (44).
Kaleem 등은 4주 동안 NS 에탄올 추출물을 처리하여 유사한 간 보호 효과를 나타냈습니다(61). 연구진은 300 mg/kg NS 에탄올 추출물이 STZ로 유도한 쥐의 간과 신장(61)에서 항산화 효소[티오바르비투르산 반응성 물질(TBARS) 및 하이드로퍼옥사이드]와 글루타치온(GSH) 및 글루타치온 퍼옥시다제(GSHPx)를 감소시키는 것을 발견했습니다. 흥미롭게도 알록산으로 유도한 토끼에 대한 연구에서도 당뇨 토끼의 LPO로 인한 간 손상을 예방하면서 GSH와 세룰로플라즈민 농도를 개선하는 것으로 나타났습니다(44).
The hepatoprotective effect of NS is not limited to its antioxidant properties as they are also shown to improve the hepatic glycogen content (43). Furthermore, they postulated that the improvement of the hepatic glycogen content is due to the advancement of insulin secretion, which promotes glycogenesis in the liver.
NS의 간 보호 효과는 간 글리코겐 함량도 개선하는 것으로 나타났기 때문에 항산화 특성에만 국한되지 않습니다(43). 또한, 연구진은 간 글리코겐 함량의 개선이 간에서 글리코겐 생성을 촉진하는 인슐린 분비의 촉진에 기인한다고 가정했습니다.
Fararh et al. supported this finding and reported NS oil extracts could decrease hepatic gluconeogenesis by reducing its precursors (alanine, glycerol, and lactate) (39) and prevent the formation of glucose.
Fararh 등은 이러한 발견을 뒷받침하는 연구 결과를 통해 NS 오일 추출물이 전구체(알라닌, 글리세롤, 젖산염)를 감소시킴으로써 간 포도당 생성을 감소시키고(39) 포도당 형성을 예방할 수 있다고 보고했습니다.
Interestingly, Sobhi et al. reported that treatment with NS seed extract did not show a hepatoprotective effect on acetaminophen following treatment for 4 weeks (52). Acetaminophen is an analgesic and antipyretic agent with a direct hepatotoxic effect in a large dose. Even though NS did not possess a protective effect on the liver from acetaminophen, no hepatotoxicity was found when tested alone in STZ-NA-induced rats. The liver plays a huge role in maintaining blood glucose levels; therefore, preserving its function is warranted as a treatment modality for DM.
흥미롭게도 Sobhi 등은 NS 종자 추출물로 4주 동안 치료한 결과 아세트아미노펜에 대한 간 보호 효과가 나타나지 않았다고 보고했습니다(52). 아세트아미노펜은 고용량으로 직접적인 간독성 효과가 있는 진통제 및 해열제입니다. NS는 아세트아미노펜으로부터 간을 보호하는 효과가 없었지만, STZ-NA 유도 쥐에서 단독으로 실험했을 때 간독성이 발견되지 않았습니다. 간은 혈당 수치를 유지하는 데 큰 역할을 하므로 간 기능을 보존하는 것이 당뇨병 치료 방법으로 권장됩니다.
Digestive enzyme inhibition (소화 효소 억제 )
Another issue faced in T2DM patients is a spike in blood sugar levels following a meal, referred to as postprandial blood glucose. Hydrolysis of carbohydrates by a digestive enzyme, such as α-amylase and α-glucosidase, contributes to the increase of blood glucose levels in the body (88). Therefore, one therapeutic strategy aimed at maintaining the blood glucose level is inhibiting these digestive enzymes. Currently, a few inhibitors are available in the market, such as voglibose and acarbose. However, the issue with these medications is the disturbing side effect, such as flatulence and digestive disorders. NS's role as an inhibitor carbohydrate digestive enzyme was studied in 2019 by Hannan et al. (65). The methanolic extract of NS causes a reduction or delaying carbohydrate digestion and absorption by improving glucose tolerance and reducing disaccharidase enzyme activity in STZ-induced diabetic rats (65).
제2형 당뇨병 환자가 직면하는 또 다른 문제는 식후 혈당이라고 하는 식사 후 혈당 수치의 급상승입니다. α-아밀라아제 및 α-글루코시다제와 같은 소화 효소에 의한 탄수화물의 가수분해는 체내 혈당 수치를 높이는데 기여합니다(88). 따라서 혈당 수치를 유지하기 위한 한 가지 치료 전략은 이러한 소화 효소를 억제하는 것입니다. 현재 보글리보스와 아카보스 등 몇 가지 억제제가 시중에 나와 있습니다. 그러나 이러한 약물의 문제는 헛배 부름과 소화 장애와 같은 불안한 부작용이 있다는 것입니다. 탄수화물 소화 효소 억제제로서 NS의 역할은 2019년에 한난 외(65)에 의해 연구되었습니다. NS의 메탄올 추출물은 STZ로 유도된 당뇨병 쥐에서 포도당 내성을 개선하고 이당분해효소 활성을 감소시킴으로써 탄수화물 소화 및 흡수를 감소시키거나 지연시킵니다(65).
Tiji et al. also reported similar findings. NS extraction reveals to cause a reduction in both intestinal α-glucosidase and pancreatic α-amylase activity, with NS acetone extract showing the greatest inhibitory effect. This suggests the possibility of the polyphenol compounds, such as catechin and gallic acid, as the main contributors to digestive enzyme inhibitory effects (67). A different finding is reported by Dalli et al. as they found that the in vitro α-amylase percentage of inhibition is greatest in the aqueous fraction (92.24%), which is similar to the positive control used in this study, Acarbose; followed by methanol (86%), ethanol (81%), dichloromethane and n-hexane fractions; both are showing 64% inhibition. In vivo assessment of the α-amylase inhibition also revealed that aqueous and an ethanolic fractions of NS reduced the glucose 30 min after the oral sucrose load. However, in the in situ glucose absorption, methanolic extract caused better control compared to the aqueous fraction. The various degrees of inhibition in different fractions suggest that the α-amylase inhibitory effect of NS is attributed to different bioactive compounds such as quercetin, kaempferol, thymoquinone and others, as shown in their HPLC and GC-MS findings (68).
티지(Tiji) 등 역시 비슷한 결과를 보고했습니다. NS 추출물은 장내 α-글루코시다아제와 췌장 α-아밀라아제 활성을 모두 감소시키는 것으로 밝혀졌으며, NS 아세톤 추출물이 가장 큰 억제 효과를 나타냈습니다. 이는 카테킨과 갈산과 같은 폴리페놀 화합물이 소화 효소 억제 효과의 주요 원인일 가능성을 시사합니다(67). Dalli 등은 이 연구에서 사용된 양성 대조군인 아카보스와 유사한 수성 분획(92.24%)에서 시험관 내 α-아밀라아제 억제율이 가장 높았으며, 메탄올(86%), 에탄올(81%), 디클로로메탄 및 n-헥산 분획에서 64%의 억제율을 보인다는 다른 결과를 보고한 바 있습니다. α-아밀라아제 저해에 대한 생체 내 평가에서도 NS의 수성 및 에탄올 분획은 경구 자당 투여 30분 후 포도당을 감소시키는 것으로 나타났습니다. 그러나 현장 포도당 흡수에서는 메탄올 추출물이 수성 분획에 비해 더 잘 조절되었습니다. 다른 분획에서 다양한 정도의 억제 효과는 NS의 α-아밀라아제 억제 효과가 퀘르세틴, 캠페롤, 티모퀴논 등과 같은 다양한 생리 활성 화합물에 기인한다는 것을 시사합니다(HPLC 및 GC-MS 결과(68)).
Interestingly, the NS digestive enzyme inhibition was also evaluated using different preparations of nanoparticles.
흥미롭게도 다양한 나노 입자 제제를 사용하여 NS 소화 효소 억제 효과도 평가했습니다.
Due to its high antioxidant potential, NS has been utilized as a capping or reducing agent in producing nanoparticles. Vijayakumar et al. reported that the silver nanoparticles synthesized using NS (NS AgNPs) possessed a high degree of inhibition in both α-amylase and α-glucosidase enzymes. They also reported an increase in the inhibition of the dipeptylpeptidase-IV enzyme (DPP-IV). DPP-IV acts by inhibiting the incretins such as GLP-1 and GIP. As the incretins stimulate insulin release, inactivation of the incretins by the DPP-IV enzyme exerts a negative response toward high blood glucose control, especially in T2DM. Inhibition of this DPP-IV enzyme could further potentiate better blood glucose control, as reported in this study. It can work similarly to gliptin, the available DPP-IV inhibitor in the market (69). In a more recent study, Veeramani et al. reported that NS-coated gold nanoparticles (AuNPs) show potent antioxidant activity in in vitro DPPH assay, as well as causing significant inhibition on α-amylase and α-glucosidase in a dose-dependent manner (27). Similarly, the microencapsulation of the hydroacetone extract of NS also reported a high α-amylase enzyme inhibition compared to acarbose, signifying that the microencapsulation of NS enhances the inhibitory effect against the carbohydrate digestive enzyme (89).
NS는 높은 항산화 잠재력으로 인해 나노 입자 생산 시 캡핑제 또는 환원제로 활용되어 왔습니다. 비자야쿠마르(Vijayakumar) 등은 NS를 사용하여 합성한 은 나노입자(NS AgNP)가 α-아밀라아제 및 α-글루코시다제 효소 모두에 대해 높은 수준의 억제 효과를 나타냈다고 보고했습니다. 또한 디펩틸펩티다제-IV 효소(DPP-IV)에 대한 억제 효과도 증가했다고 보고했습니다. DPP-IV는 GLP-1 및 GIP와 같은 인크레틴을 억제하는 방식으로 작용합니다. 인크레틴은 인슐린 분비를 자극하기 때문에 DPP-IV 효소에 의한 인크레틴의 비활성화는 특히 제2형 당뇨병에서 고혈당 조절에 부정적인 반응을 일으킵니다. 이 연구에서 보고된 바와 같이, 이 DPP-IV 효소를 억제하면 혈당 조절을 더욱 강화할 수 있습니다. 시판 중인 DPP-IV 억제제인 글립틴과 유사하게 작용할 수 있습니다(69). 더 최근의 연구에서 비라마니 등은 NS 코팅 금 나노입자(AuNP)가 체외 DPPH 분석에서 강력한 항산화 활성을 보일 뿐만 아니라 용량 의존적으로 α-아밀라아제 및 α-글루코시다아제에 대한 유의한 억제 효과를 나타낸다고 보고했습니다(27). 마찬가지로, NS의 하이드로 아세톤 추출물의 마이크로 캡슐화는 아카보스에 비해 높은 α- 아밀라아제 효소 억제 효과를 보고했는데, 이는 NS의 마이크로 캡슐화가 탄수화물 소화 효소에 대한 억제 효과를 향상시킨다는 것을 의미합니다(89).
Clinical trials (임상시험)
Due to the promising NS antidiabetic potential shown in preclinical studies, clinical trials have been conducted to translate the findings into clinical use. In this review, 13 clinical trials were selected, as summarized in Table 3. However, in these clinical studies, patients are on the standard regime of an oral hypoglycaemic agent (OHA) or other medications (antihypertensive and antihyperlipidemic agents).
전임상 연구에서 나타난 NS의 유망한 항당뇨 잠재력으로 인해, 그 결과를 임상으로 전환하기 위한 임상시험이 수행되었습니다. 이 리뷰에서는 표 3에 요약된 바와 같이 13개의 임상시험을 선정했습니다. 그러나 이러한 임상시험에서 환자들은 경구 혈당 강하제(OHA) 또는 기타 약물(항고혈압제 및 항고지혈증제)의 표준 요법을 받고 있습니다.
Table 3
Summary of NS's effects on DM from clinical trials.
|
Study design
|
Dosage
|
Duration of study
|
Outcomes of the study
|
References
|
|
Interventional study (pre–post study) 41 patients with T2DM
|
0.7 g/day NS oil
|
80 days
|
↓ FBG
↑ Insulin and AST levels |
(90)
|
|
Interventional study (pre–post study) 94 patients with T2DM, three groups
|
1, 2, and 3 g/day powdered NS
|
12 weeks
|
2 g/day dosage caused
↓ FBG, 2 h post-prandial glucose and HbA1c |
(91)
|
|
Interventional study (pre–post study) 66 T2DM, 2 groups (n = 41, 25)
|
5 g/day NS aqueous extract (NS tea)
|
6 months
|
↓ FBG, 2 h post-prandial glucose, HbA1c, AST, ALT, total serum bilirubin, creatinine, and blood urea
|
(92)
|
|
Randomized, double-blinded control trial 70 patients with T2DM, 2 groups (n = 35)
|
5 mL/day NS oil
|
1 year
|
↓ FBG, 2 h post-prandial glucose, HbA1c, and body weight
|
(93)
|
|
Randomized, single-blinded control trial 114 patients with T2DM, 2 groups (n = 57)
|
2 g/day powdered NS
|
1 year
|
↓ FBG, insulin resistance, HbA1c, and TBARS
↑ TAC, SOD, and GSH Improved β cell activity |
(94)
|
|
Randomized, single-blinded control trial 60 patients with T2DM, 2 groups (n = 30)
|
2 g/day powdered NS
|
1 year
|
↓ HbA1c
Protects the heart from diastolic dysfunction Improves left ventricle systolic function |
(95)
|
|
Randomized, double-blind, placebo-controlled clinical trial 43 patients with T2DM (n = 20, 23)
|
500 mg/day NS oil
|
8 weeks
|
↓ FBG, TC, LDL-C, TGs, BMI, and blood pressure (SBP and DBP)
|
(96)
|
|
Prospective, open-label randomized clinical trial at outpatient endocrinology clinic 44 newly diagnosed patients with T2DM (n = 23, 21)
|
450 mg/3 times per day NS oil
|
3 months
|
↓ Body weight, weight circumference, and BMI
↑ Fasting insulin; HDL-C and TAC ↓ ALT; TC, LDL-C, TGs |
(97)
|
|
Double-blind randomized clinical trial study 50 patients with T2DM
|
1,000 mg NS oil in two capsules
|
8 weeks
|
↓ FBG, TGs, TC, LDL-C, serum CRP, and MDA
↑ Serum HDL-C |
(98)
|
|
Prospective, open-label, second-phase trial 94 patients with T2DM, three groups
|
1, 2, and 3 g/day powdered NS
|
12 weeks
|
2 g/day NS displayed significant
↓ TC, TGs and LDL-C and significant ↑ HDL-C/LDL-C. |
(99)
|
|
Single-blind, non-randomized 114 patients with T2DM, 2 groups (n = 57)
|
2 g/day powdered NS
|
1 year
|
↓ SBP, DBP, MAP, TC, LDL-C, TC/HDL-C ratio, and LDL-C/HDL-C ratio
|
(100)
|
|
Randomized control trial 68 patients with T2DM, 2 groups (n = 34)
|
2.5 mL/day NS oil
|
12 weeks
|
↓ Blood glucose, serum creatinine, blood urea and 24 h total urinary protein levels
↑ Glomerular filtration rate, 24 h total urinary volume and hemoglobin level |
(101)
|
|
Randomized, double-blind, placebo-controlled trial 72 patients with T2DM, 2 groups (n = 36)
|
3 g/day NS oil
|
12 weeks
|
↓ Fasting blood sugar, HbA1c, TGs, LDL-C, insulin resistance
↑ Insulin and HDL-C |
(102)
|
표 3
임상 시험에서 DM에 대한 NS의 효과 요약.
|
연구 설계
|
복용량
|
연구 기간
|
연구 결과
|
참고자료
|
|
중재 연구(사후 연구) T2DM 환자 41명
|
NS 오일 0.7g/일
|
80일
|
↓ FBG
↑ 인슐린 및 AST 수준 |
( 90 )
|
|
중재 연구(사후 연구) T2DM 환자 94명, 3개 그룹
|
1, 2, 3g/일 분말 NS
|
12주
|
1일 2g 투여량
↓ FBG, 식후 2시간 혈당 및 HbA1c 발생 |
( 91 )
|
|
중재 연구(사전-사후 연구) 66 T2DM, 2개 그룹( n = 41, 25)
|
NS수성추출물(NS차) 5g/일
|
6 개월
|
↓ FBG, 식후 2시간 혈당, HbA1c, AST, ALT, 총 혈청 빌리루빈, 크레아티닌, 혈액요소
|
( 92 )
|
|
무작위 이중 맹검 대조 시험 T2DM 환자 70명, 2개 그룹( n = 35)
|
NS 오일 5mL/일
|
일년
|
↓ FBG, 식후 2시간 혈당, HbA1c, 체중
|
( 93 )
|
|
무작위, 단일 맹검 대조 시험 T2DM 환자 114명, 2개 그룹( n = 57)
|
2g/일 분말 NS
|
일년
|
↓ FBG, 인슐린 저항성, HbA1c, TBARS
↑ TAC, SOD, GSH 베타세포 활성 개선 |
( 94 )
|
|
무작위, 단일 맹검 대조 시험 T2DM 환자 60명, 2개 그룹( n = 30)
|
2g/일 분말 NS
|
일년
|
↓ HbA1c
확장기 기능 장애로부터 심장을 보호합니다. 좌심실 수축기 기능을 향상시킵니다. |
( 95 )
|
|
무작위, 이중 맹검, 위약 대조 임상 시험 43명의 T2DM 환자( n = 20, 23)
|
NS 오일 500mg/일
|
8주
|
↓ FBG, TC, LDL-C, TG, BMI 및 혈압(SBP 및 DBP)
|
( 96 )
|
|
외래 내분비학 클리닉에서 전향적 공개 무작위 임상 시험 새로 진단된 T2DM 환자 44명( n = 23, 21)
|
1일 3회 450mg NS 오일
|
3 개월
|
↓ 체중, 체중둘레, BMI
↑ 공복 인슐린; HDL-C 및 TAC ↓ ALT; TC, LDL-C, TG |
( 97 )
|
|
이중 맹검 무작위 임상 시험 연구 T2DM 환자 50명
|
캡슐 2개에 NS 오일 1,000mg 함유
|
8주
|
↓ FBG, TGs, TC, LDL-C, 혈청 CRP 및 MDA
↑ 혈청 HDL-C |
( 98 )
|
|
전향적, 공개, 2상 시험 T2DM 환자 94명, 3개 그룹
|
1, 2, 3g/일 분말 NS
|
12주
|
2g/일 NS는 유의미한
↓ TC, TG 및 LDL-C와 유의미한 ↑ HDL-C/LDL-C를 나타냈습니다. |
( 99 )
|
|
단일 맹검, 비무작위화 T2DM 환자 114명, 2개 그룹( n = 57)
|
2g/일 분말 NS
|
일년
|
↓ SBP, DBP, MAP, TC, LDL-C, TC/HDL-C 비율, LDL-C/HDL-C 비율
|
( 100 )
|
|
무작위 대조 시험 T2DM 환자 68명, 2개 그룹( n = 34)
|
NS 오일 2.5mL/일
|
12주
|
↓ 혈당, 혈청 크레아티닌, 혈액 요소 및 24시간 총 요단백 수치
↑ 사구체 여과율, 24시간 총 요량 및 헤모글로빈 수치 |
( 101 )
|
|
무작위, 이중 맹검, 위약 대조 시험 T2DM 환자 72명, 2개 그룹( n = 36)
|
NS 오일 3g/일
|
12주
|
↓ 공복 혈당, HbA1c, TG, LDL-C, 인슐린 저항성
↑ 인슐린 및 HDL-C |
( 102 )
|
Similar to in vitro and in vivo studies, the clinical trials revealed that NS has the potential as a supplementary treatment for T2DM. The duration used for the clinical trials ranges from 8 weeks (96, 98) up to 1 year (93–95). The treatment of T2DM for 8 weeks with NS oil has shown marked improvement in terms of glycaemic control (decreased in FBG and HbA1c and increased insulin level) and the amelioration of the lipid profile (considerable reduction in T-cholesterol, LDL and TG and an increase in HDL). The improvement in these parameters could help minimize the cardiometabolic risk factors in T2DM (96, 98). Furthermore, hyperlipidaemia is considered as one of the important triggers of the oxidative inflammatory cascade in T2DM (76); therefore, NS's hypolipidaemic property could reduce the risk of T2DM progression and complications (98–100).
시험관 및 생체 내 연구와 마찬가지로 임상 시험에서도 NS가 제2형 당뇨병의 보조 치료제로서의 잠재력이 있는 것으로 나타났습니다. 임상 시험에 사용된 기간은 8주(96, 98)에서 최대 1년(93-95)까지입니다. NS 오일로 8주 동안 제2형 당뇨병을 치료한 결과 혈당 조절(당화혈색소 및 당화혈색소 수치 감소, 인슐린 수치 증가)과 지질 프로필 개선(T-콜레스테롤, LDL 및 TG의 상당한 감소 및 HDL의 증가) 측면에서 현저한 개선이 나타났습니다. 이러한 매개 변수의 개선은 제2형 당뇨병의 심장 대사 위험 요소를 최소화하는 데 도움이 될 수 있습니다 (96, 98). 또한 고지혈증은 제2형 당뇨병에서 산화성 염증 캐스케이드의 중요한 유발 요인 중 하나로 간주되므로(76), NS의 고지혈증 완화 특성은 제2형 당뇨병 진행 및 합병증의 위험을 감소시킬 수 있습니다(98-100).
Also, ameliorating dyslipidaemia could help improve cardiovascular function in patients with T2DM. Hadi et al. further reported that along with the improvement in lipid profile, patients had shown a substantial decrease in BMI, waist circumference, systolic blood pressure (SBP) and diastolic blood pressure (DBP) at a dose of 500 mg NS daily (96). This finding is supported further by Bamosa et al., who found that treatment with 2 g powdered NS for a year could reduce blood pressure, protect the heart from diastolic dysfunction and improve left ventricular (LV) systolic function (95). In this study, an echocardiogram was performed at baseline and repeated at 6 and 12 months follow-ups to evaluate the cardiac function of patients with T2DM. They found that NS could preserve diastolic function by monitoring the transmitral flow ratio, which was substantially reduced in the placebo group. In addition, NS also protects the heart from the development of LV hypertrophy and improves systolic function.
또한 이상지질혈증을 개선하면 제2형 당뇨병 환자의 심혈관 기능을 개선하는 데 도움이 될 수 있습니다. Hadi 등은 지질 프로필의 개선과 함께 환자가 매일 500mg NS를 복용했을 때 BMI, 허리둘레, 수축기 혈압(SBP) 및 이완기 혈압(DBP)이 크게 감소했다고 보고했습니다(96). 이 결과는 1년간 2g 분말 NS로 치료하면 혈압을 낮추고 이완기 기능 장애로부터 심장을 보호하며 좌심실(LV) 수축기 기능을 개선할 수 있다는 사실을 발견한 Bamosa 등의 연구에 의해 더욱 뒷받침됩니다(95). 이 연구에서는 제2형 당뇨병 환자의 심장 기능을 평가하기 위해 기저시점에서 심초음파 검사를 시행하고 6개월 및 12개월 추적 관찰 시 반복적으로 심초음파 검사를 시행했습니다. 연구팀은 위약 그룹에서 현저히 감소한 관류율을 모니터링하여 NS가 이완기 기능을 보존할 수 있음을 발견했습니다. 또한 NS는 좌심실 비대로부터 심장을 보호하고 수축기 기능을 개선합니다.
The cardioprotective effect of NS was consistent with the animal studies, which showed a reduction in oxidative stress parameters in the aorta and cardiac tissue following the treatment with hydroalcoholic extract of NS for 6 weeks in STZ-induced diabetic rats (47). This result suggests that ameliorating oxidative stress is one of the NS's potential actions in causing improvement in cardiac function in DM. This antioxidant effect is further supported by Kaatabi et al., who reported a considerable increase in total antioxidant capacity (TAC), CAT, GSH and SOD and a remarkable reduction in TBARS following treatment with 500 mg NS powdered capsule in T2DM patients (94). This finding is consistent with a study by Kooshki et al., which showed a reduction in serum MDA, the LPO by-product, in patients with T2DM treated with 1,000 mg NS for 8 weeks (98). The improvement in antioxidant enzymes could help minimize oxidative stress progression in T2DM and could be a mechanism contributing to the hypoglycaemic effect of NS.
NS의 심장 보호 효과는 STZ로 유도된 당뇨병 쥐에서 6주간 NS의 하이드로알코올 추출물을 처리한 후 대동맥과 심장 조직에서 산화 스트레스 매개변수가 감소한 것으로 나타난 동물 연구 결과와 일치했습니다(47). 이 결과는 산화 스트레스를 개선하는 것이 DM에서 심장 기능 개선을 유발하는 NS의 잠재적인 작용 중 하나임을 시사합니다. 이러한 항산화 효과는 제2형 당뇨병 환자에서 500mg NS 분말 캡슐로 치료한 후 총 항산화 능력(TAC), CAT, GSH 및 SOD가 상당히 증가하고 TBARS가 현저히 감소했다고 보고한 Kaatabi 등(94)에 의해 더욱 뒷받침됩니다. 이 결과는 8주 동안 1,000mg NS로 치료한 제2형 당뇨병 환자에서 LPO 부산물인 혈청 MDA가 감소한 것으로 나타난 Kooshki 등의 연구 결과와 일치합니다(98). 항산화 효소의 개선은 제2형 당뇨병에서 산화 스트레스 진행을 최소화하는 데 도움이 될 수 있으며 NS의 저혈당 효과에 기여하는 메커니즘이 될 수 있습니다.
Kaatabi et al. also reported increased pancreatic β cell activity with considerably lower insulin resistance after a year of NS treatment (94). A similar finding was reported by Bamosa et al. who demonstrated that treatment with NS oil for 12 weeks helps in the reduction of insulin resistance calculated by HOMA-IR and the improvement of β cell function in a non-controlled trial study (91). Another study reported that the effects of NS on fasting insulin and insulin resistance in newly diagnosed patients with T2DM were comparable to the standard oral hypoglycaemic agent (OHA) metformin following treatment for 3 months (97). However, different studies reported that NS causes a reduction in FBG, but no remarkable differences in insulin secretion and HOMA-IR after adjusting for changes in body weight, dietary intake and baseline value (102). This result suggests that the clinical study outcome is heavily influenced by the dosage, duration, type of clinical study, dietary intake, baseline glucose, ethnicity and activity.
Kaatabi 등은 1년간의 NS 치료 후 췌장 베타 세포 활동이 증가하여 인슐린 저항성이 상당히 낮아졌다고 보고했습니다(94). 바모사(Bamosa) 등은 비대조 시험 연구에서 12주 동안 NS 오일로 치료하면 HOMA-IR로 계산한 인슐린 저항성이 감소하고 β 세포 기능이 개선된다는 사실을 입증했습니다(91). 또 다른 연구에서는 새로 진단받은 제2형 당뇨병 환자의 공복 인슐린과 인슐린 저항성에 대한 NS의 효과가 3개월 동안 치료한 후 표준 경구 혈당 강하제(OHA) 메트포르민과 비슷하다고 보고했습니다(97). 그러나 다른 연구에서는 NS가 FBG를 감소시키지만 체중, 식이 섭취량 및 기저값의 변화를 조정한 후에도 인슐린 분비량과 HOMA-IR에 현저한 차이가 없다고 보고했습니다(102). 이 결과는 임상 연구 결과가 복용량, 기간, 임상 연구 유형, 식이 섭취량, 기저 혈당, 인종 및 활동량에 따라 크게 영향을 받는다는 것을 시사합니다.
The improvement in pancreatic β-cell function has also reported widely in in vitro (66) and in vivo diabetes studies (38, 41, 43, 45, 53, 62, 63). The amelioration of β-cell function could explain the improvement of insulin levels and the overall fasting and post-prandial blood glucose levels in clinical trials (91–93). The improvement in post-prandial blood glucose could be attributed partially to the inhibition of the carbohydrate digestion enzyme by NS (52, 67, 68). Post-prandial blood glucose control helps prevent the post-meal spike in blood glucose levels, which is crucial in preventing T2DM progression and complications. After NS treatment, improvement in glycated hemoglobin levels resulted a well-controlled blood glucose level (91–95, 102). The organ-protecting effect was also observed in the liver and kidney, in which treatment with NS caused a reduction in serum creatinine and urea with improvement in glomerular filtration rate and 24 h urinary volume (101) and a reduction in ALT (90), AST and total serum bilirubin (92).
췌장 베타세포 기능의 개선은 시험관(66) 및 생체 내 당뇨병 연구(38, 41, 43, 45, 53, 62, 63)에서도 광범위하게 보고되었습니다. β 세포 기능의 개선은 임상 시험에서 인슐린 수치와 전반적인 공복 및 식후 혈당 수치의 개선을 설명할 수 있습니다(91-93). 식후 혈당의 개선은 부분적으로 NS에 의한 탄수화물 소화 효소의 억제에 기인할 수 있습니다(52, 67, 68). 식후 혈당 조절은 식후 혈당 수치가 급격히 상승하는 것을 방지하는 데 도움이 되며, 이는 T2DM 진행과 합병증을 예방하는 데 매우 중요합니다. NS 치료 후 당화혈색소 수치가 개선된 결과 혈당 수치가 잘 조절되었습니다(91-95, 102). 간과 신장에서도 장기 보호 효과가 관찰되었는데, NS 치료 후 혈청 크레아티닌과 요소가 감소하고 사구체 여과율과 24시간 소변량이 개선되었으며(101), ALT(90), AST 및 총 혈청 빌리루빈이 감소했습니다(92).
Discussion (논의)
NS belongs to the genus Nigella in the family Ranunculaceae. Some of the plants belonging to this genus include N. damascene, N. arvensis, N. hispanica, N. nigellastrum and N. orientalis. Compared to the other plants in the same genus, only NS has reported antidiabetic properties. However, phytochemical evaluations of these plants show that they possess bioactive compounds, which could be beneficial in managing DM, such as quercetin, quercitrin, hyperoside, carvacrol, thymohydroquinone, and kaempferol, to name a few (103). These compounds have been studied extensively and show potential antioxidant, anti-inflammatory and antiapoptotic properties. N. damascene, one of the plants from the same genus, was reported to have antioxidant effects owing to its quercetin and its derivative content. The polar extract of NS was also shown to possess a wide range of phenolic compounds, which were found to have high antioxidant capacity. However, the potential effect of nigella genus plants is not only limited to the antioxidant activity as they are also reported to ameliorate dyslipidaemia. Kokdil et al. reported the administration of N. orientalis and N. segetalis fixed oils orally (1 mL/kg/day) on Wistar Kyoto rats for 4 weeks increased HDL-C and N. orientalis also caused a decrease in LDL-C and VLDL-C. Both plants also increased the total antioxidant status in the experimental rats (104). Due to the high potential of NS, the other plant of the same genus should be explored to unravel their antidiabetic potential further.
NS는 미나리아재비과의 니겔라 속에 속합니다. 이 속에 속하는 식물 중 일부는 N. 다마센, N. 아르벤시스, N. 히스패니카, N. 니겔라스트럼 및 N. 오리엔탈리스를 포함합니다. 같은 속의 다른 식물과 비교하여 NS만이 항당뇨 특성을 보고했습니다. 그러나 이러한 식물에 대한 식물 화학적 평가에 따르면 케르세틴, 케르시트린, 하이페로사이드, 카르바크롤, 티모하이드로퀴논, 캄페롤 등 당뇨병 관리에 도움이 될 수 있는 생리 활성 화합물이 함유되어 있는 것으로 나타났습니다(103). 이러한 화합물은 광범위하게 연구되었으며 잠재적인 항산화, 항염증 및 항세포 사멸 특성을 보여줍니다. 같은 속 식물 중 하나인 N. 다마센은 케르세틴과 그 유도체 함량으로 인해 항산화 효과가 있는 것으로 보고되었습니다. NS의 극성 추출물은 또한 항산화 능력이 높은 것으로 밝혀진 광범위한 페놀 화합물을 함유하고 있는 것으로 나타났습니다. 그러나 니겔라 속 식물의 잠재적 효과는 이상 지질 혈증을 개선하는 것으로보고 되었기 때문에 항산화 활성에만 국한되지 않습니다. 콕딜(Kokdil) 등은 4주 동안 위스타 교토 쥐에 N. 오리엔탈리스와 N. 세게탈리스 고정 오일을 경구 투여(1mL/kg/일)한 결과 HDL-C가 증가했으며, N. 오리엔탈리스도 LDL-C와 VLDL-C를 감소시켰다고 보고했습니다. 두 식물은 또한 실험 쥐의 총 항산화 상태를 증가시켰습니다 (104). NS의 잠재력이 높기 때문에 같은 속의 다른 식물에 대해서도 항당뇨 잠재력을 더 밝혀내야 합니다.
The in vivo and in vitro trials have shown a wide array of NS potential to be utilized as hypoglycaemic agents. Some NS actions considered the main attributes of its antidiabetic potentials are antioxidant, anti-inflammatory and insulin-mimetic properties. Additionally, the action of NS in lowering blood glucose levels mimics the currently available OHAs in the market. For instance, similar to Metformin, NS is shown to activate the AMPK pathway (59), enhance insulin sensitivity and glucose uptake and fatty acid oxidation, and reduce intestinal glucose absorption (60). Not only that, NS has proven potential in the modulation of the carbohydrate digestive enzyme to prevent and control the fluctuations of postprandial blood glucose level, similar to the actions of miglitol, voglibose, and acarbose, currently available antidiabetic drugs that are prescribed to T2DM patients. Other than its individual effects, NS could potentiate the effect of these antidiabetic drugs, and synergise the effect, which could help in more holistic control in managing the blood glucose level. Furthermore, the dosage of the medication and the toxicity could be reduced when applied in combination, hence improving the patients' overall outcome.
생체 내 및 시험관 내 실험을 통해 혈당 강하제로 활용될 수 있는 다양한 NS의 잠재력이 밝혀졌습니다. 항당뇨 잠재력의 주요 특성으로 간주되는 일부 NS 작용은 항산화, 항염증 및 인슐린 모방 특성입니다. 또한 혈당 수치를 낮추는 NS의 작용은 현재 시중에 판매되는 OHA와 유사합니다. 예를 들어, 메트포르민과 유사하게 NS는 AMPK 경로를 활성화하고(59), 인슐린 감수성과 포도당 흡수 및 지방산 산화를 개선하며, 장내 포도당 흡수를 감소시키는 것으로 나타났습니다(60). 뿐만 아니라 NS는 탄수화물 소화 효소를 조절하여 식후 혈당 수치의 변동을 예방하고 조절할 수 있는 잠재력이 입증되었으며, 이는 현재 제2형 당뇨병 환자에게 처방되는 항당뇨병 약물인 미글리톨, 보글리보스, 아카보스의 작용과 유사합니다. NS는 개별적인 효과 외에도 이러한 항당뇨병 약물의 효과를 강화하고 시너지 효과를 발휘하여 혈당 수치를 보다 총체적으로 관리하는 데 도움이 될 수 있습니다. 또한, 병용 투여시 약물의 용량과 독성을 줄일 수 있어 환자의 전반적인 결과를 개선할 수 있습니다.
Based on the clinical trials, several DM biomarkers could be assessed to trace the effects of NS and its bioactive compound in causing the desired effect. The potential biosensing marker could be the basis of DM parameters such as fasting and post-prandial blood glucose level and glycated hemoglobin; to evaluate the long-term blood glucose control as well as compliance toward the treatment and the plasma insulin level. Additionally, the cardiometabolic biosensing marker, such as lipid profile, could be monitored to prevent progression toward diabetic cardiomyopathy (105). However, it should not be left unnoticed that in these clinical trials, patients are still on the OHA's, which means the effects seen in these patients are synergistic effects with the medication they took rather than individual effects of NS. Future studies must be conducted to evaluate the NS effects in the combination of OHA and its pharmacological and toxicological profile for future clinical applications.
임상시험을 기반으로 여러 당뇨병 바이오마커를 평가하여 NS와 그 생리활성 화합물이 원하는 효과를 유발하는 효과를 추적할 수 있습니다. 잠재적인 바이오센싱 마커는 공복 및 식후 혈당 수치와 당화혈색소와 같은 DM 파라미터의 기초가 될 수 있으며, 장기적인 혈당 조절과 치료에 대한 순응도 및 혈장 인슐린 수치를 평가할 수 있습니다. 또한 지질 프로필과 같은 심장 대사 생체 감지 마커를 모니터링하여 당뇨병성 심근증으로의 진행을 예방할 수 있습니다(105). 그러나 이러한 임상시험에서 환자들은 여전히 OHA를 복용하고 있으며, 이는 이 환자들에게서 나타난 효과가 NS의 개별적인 효과라기보다는 복용 중인 약물과의 시너지 효과라는 점을 간과해서는 안 됩니다. 향후 임상 적용을 위해 OHA와 약리학적 및 독성학적 프로파일을 결합한 NS 효과를 평가하기 위해 향후 연구가 수행되어야 합니다.
However, despite numerous studies showing NS promising results to be utilized in DM management, it is still bound to several limitations that require attention before clinical application. Similar to other plant resources, the NS's bioavailability in terms of solubility, stability and half-life remains the main issue in elucidating the warranted effects. Modulation of the structure and different doses and strategies have been studied extensively in preclinical settings, which gives a wide array of information before safely being conducted in the clinical trial. Additionally, the drug-herb interaction is another important issue to be further validated to ensure clinical therapeutic efficacy. It may cause risks of unwanted pharmacokinetic and pharmacodynamic interactions when co-administered. Hence, a more structured and extensive human trial is needed to further verify the mechanism of action, pharmacological effect, the range of safe doses and toxicological profile before utilizing NS as an antidiabetic agent.
그러나 NS가 당뇨병 관리에 활용될 수 있는 유망한 결과를 보여주는 수많은 연구에도 불구하고 여전히 임상 적용 전에 주의가 필요한 몇 가지 한계가 있습니다. 다른 식물 자원과 마찬가지로 용해도, 안정성 및 반감기 측면에서 NS의 생체 이용률은 보증된 효과를 규명하는 데 있어 주요 문제로 남아 있습니다. 구조의 조절과 다양한 용량 및 전략은 전임상 환경에서 광범위하게 연구되어 임상시험에서 안전하게 수행되기 전에 다양한 정보를 제공합니다. 또한 약물과 허브의 상호 작용은 임상 치료 효능을 보장하기 위해 추가로 검증해야 할 또 다른 중요한 문제입니다. 약초와 약물을 병용 투여할 경우 원치 않는 약동학 및 약력학적인 상호작용의 위험이 발생할 수 있습니다. 따라서 NS를 항당뇨병제로 활용하기 전에 작용 기전, 약리 효과, 안전한 용량 범위 및 독성학적 프로파일을 추가로 검증하기 위해 보다 체계적이고 광범위한 인체 임상시험이 필요합니다.
Conclusion (결론)
This review article demonstrates the therapeutic potential of NS could be used as a complement or adjuvant for the management of DM and its complications. Various preparations of NS have been studied to provide therapeutic strategies for maximizing the antidiabetic effects of NS. NS exhibits multifactorial activities that target several tissues at the same time owing to its phytochemical properties. The proposed mechanism includes ameliorating oxidative, inflammatory, apoptotic, and insulinotropic effects and inhibiting carbohydrate-digesting enzymes, to name a few. Similar promising hypoglycaemic effects have been found in clinical studies involving real patients with T2DM, further validating the potential of NS. As a whole, NS appears to play a role as a complement or adjuvant in managing DM and its complications. However, future research should be able to replicate and fill in the gaps to introduce NS safely in patients with DM.
이 리뷰 기사는 NS의 치료 잠재력이 당뇨병과 그 합병증 관리를 위한 보완제 또는 보조제로 사용될 수 있음을 보여줍니다. NS의 항당뇨 효과를 극대화하기 위한 치료 전략을 제공하기 위해 다양한 NS 제제가 연구되었습니다. NS는 식물 화학적 특성으로 인해 여러 조직을 동시에 표적으로하는 다인자 활성을 나타냅니다. 제안된 메커니즘에는 산화, 염증, 세포 사멸 및 인슐린 저항성 효과 개선과 탄수화물 소화 효소 억제 등이 포함됩니다. 실제 제2형 당뇨병 환자를 대상으로 한 임상 연구에서도 이와 유사한 유망한 저혈당 효과가 발견되어 NS의 잠재력이 더욱 입증되었습니다. 전반적으로 NS는 당뇨병과 그 합병증을 관리하는 데 있어 보완제 또는 보조제로서의 역할을 하는 것으로 보입니다. 그러나 향후 연구를 통해 부족한 부분을 보완하여 당뇨병 환자에게 안전하게 NS를 도입할 수 있어야 합니다.
Author contributions (저자 기고)
MM, SA, and MK: conceptualization, methodology, and writing—review and editing. SA, NM, EA, and MA: writing—original draft preparation. SA and EA: visualization. All authors have read and agreed to the published version of the manuscript.
MM, SA, MK: 개념화, 방법론, 글 작성-검토 및 편집. SA, NM, EA, MA: 초안 작성-초안 준비. SA 및 EA: 시각화. 모든 저자는 출판된 버전의 원고를 읽고 동의했습니다.
Conflict of interest (이해 상충)
The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
저자는 이 연구가 잠재적 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 수행되었음을 선언합니다.
Publisher's note (발행인 참고 사항)
All claims expressed in this article are solely those of the authors and do not necessarily represent those of their affiliated organizations, or those of the publisher, the editors and the reviewers. Any product that may be evaluated in this article, or claim that may be made by its manufacturer, is not guaranteed or endorsed by the publisher.
이 문서에 표현된 모든 주장은 전적으로 저자의 주장일 뿐이며, 해당 저자의 소속 기관이나 출판사, 편집자 및 검토자의 주장을 반드시 대변하는 것은 아닙니다. 이 문서에서 평가할 수 있는 제품 또는 제조업체가 주장할 수 있는 모든 제품은 게시자가 보증하거나 보증하지 않습니다.
REFERENCES (참조) - 생략
'게시판' 카테고리의 다른 글
| 제2형 당뇨병, 심혈관 질환 및 류마티스 관절염 질환을 조절하는 니겔라 사티바(블랙씨드) : 분자적 측면 (0) | 2024.06.09 |
|---|---|
| 니겔라 사티바(블랙씨드)가 특정 위장 질환에 미치는 영향 (0) | 2024.06.07 |
| 니겔라 사티바(블랙씨드) : 만성 질환 관리의 귀중한 관점 (0) | 2024.06.07 |
| 고혈압의 약물 치료 관리를 위한 잠재적 인 허브, 니겔라 사티바 (블랙씨드) : 검토 (0) | 2024.06.07 |
| 니겔라 사티바(블랙씨드)와 그 활성 성분(티모퀴논)의 항당뇨 활동 : 인체 및 실험동물 연구 검토 (0) | 2024.06.07 |